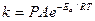|
|
Теория активных столкновенийТеория активных столкновений ТАС (С. Аррениус) основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии активации. В теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты совершается в момент столкновения активных молекул и протекает мгновенно. При этом молекулы рассматриваются как бесструктурные частицы. Согласно молекулярно-кинетической теории энергия активации равна разности между средней энергией активных столкновений и средней энергией всех столкновений. Доля активных молекул составляет от 10‒20 до 10‒10. Если эта доля меньше, то скорость реакции мала, если больше – реакция проходит практически мгновенно. Чем выше энергия активации данной реакции, тем при более высоких температурах она совершается. Энергия активации ниже энергии диссоциации реагирующих молекул, т.к. для протекания реакции достаточно такого ослабления связей в молекулах, при котором начинают преобладать силы образования новых связей. Реакции между ионами в растворе происходят с небольшой энергией активации, которая требуется для дегидратации ионов. Реакции между свободными атомами и радикалами энергии активации не требуют, т.к. атомы и радикалы сами по себе являются активными частицами. В гомогенных газовых реакциях основным источником активации служат столкновения, доля которых определяется законом распределения Больцмана и растет с температурой. В гетерогенных каталитических реакциях источниками активации могут служить изменения, происходящие в реагирующих молекулах при адсорбции их поверхностью катализатора. Активация молекул может быть вызвана внешними причинами: свет, радиация, электрический разряд и т.д. При подсчете числа столкновений нужно учитывать эффективный диаметр молекул s. Согласно молекулярно-кинетической теории газов полное число столкновений за 1 с в 1 м3 между двумя разными молекулами
где N – число молекул газа в 1 м3, m – масса молекулы газа, кг. Если молекулы одинаковые, то общее число столкновений:
Активными будут столкновения, в которых суммарная энергия поступательного движения по линии, соединяющей центры сталкивающихся молекул, больше или равна энергии активации:
Число молекул, энергия которых будет больше или равна заданного значения энергии Е определяется уравнение распределения Больцмана:
Число активных столкновений рассчитывается на основании распределения Больцмана-Максвелла:
С другой стороны число активных столкновений определяет скорость процесса:
Отсюда уравнение константы скорости при столкновении неодинаковых молекул:
Полученное уравнение можно считать теоретическим обоснованием уравнения Аррениуса. Энергия активации в теории активных столкновений не вычисляется, а определяется из экспериментальной зависимости скорости реакции от температуры Предэкспоненциальный множитель в уравнении Аррениуса в рамках теории активных соударений:
равен числу столкновений в 1 см3 за 1 с при единичной концентрации реагирующих веществ (1 моль/см3). Для бимолекулярных реакций постоянная Аррениуса имеет порядок 1014 ‒ 1015 см3/(моль·с). Величина А мало зависит от температуры. Множитель Произведение Относительная скорость движения молекул определяется уравнением
и при температурах, близких к нормальным, имеет порядок 105 см/с. Несовпадение экспериментальных и теоретических значений констант скорости обычно объясняют тем, что часть столкновений молекул, имеющих необходимую энергию активации, не приводит к успеху в виду столкновений молекул с неактивными частицами. Доля столкновений, приводящая к конечному результату, учитывается так называемым стерическим фактором Р:
При неблагоприятной ориентации молекул по отношению друг к другу P < 1, при благоприятной Р = 1. Стерический фактор в большинстве случаев характеризует вероятность определенной геометрической конфигурации частиц при столкновении. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
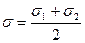
 ,
,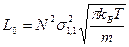
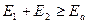

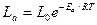
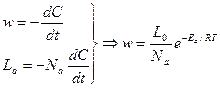
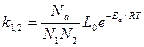
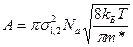 ,
, 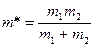
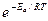 определяет долю активных столкновений.
определяет долю активных столкновений.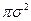 называется сечением столкновений имеет порядок 10‒15 ‒ 10‒14 см2.
называется сечением столкновений имеет порядок 10‒15 ‒ 10‒14 см2.