
|
|
Двусторонние (обратимые) реакцииДвусторонние реакции первого порядка состоят из прямой и обратной элементарных реакций первого порядка:
Материальный баланс этой реакции:
Здесь следует учесть принцип детального равновесия: в состоянии равновесия любая элементарная стадия протекает с одинаковой скоростью как в прямом, так и в обратном направлении. Общая скорость протекания процесса будет определяться разностью скоростей прямой и обратной реакций.
В приближении первого порядка реакции:
Дифференциальное уравнение общей скорости процесса через пробег реакции:
После интегрирования получаем
где K ‒ константа равновесия реакции; Решая полученную систему получим:
Замечание: если при t = 0 CB,0 = 0, то
Параллельные реакции первого порядка Параллельные реакции протекают в нескольких направлениях. Для двух односторонних реакций 1-го порядка
Скорости первой и второй реакций не зависят друг от друга. Общая скорость процесса (расхода исходного вещества) определяется суммой скоростей реакций w = w1 + w2. Соответственно общая константа скорости k = k1 + k2. Материальный баланс этой реакции:
Пробег реакции
Изменение концентрации вещества А в единичный момент времени Общая скорость параллельной реакции равна сумме скорости отдельных параллельных реакций:
Концентрация продуктов реакции в любой момент времени пропорциональна соответствующим константам скорости. Соотношение Интегральная селективность реакции Вывод уравнений констант скорости Скорость реакции:
Реакция Скорость образования вещества В
Константа скорости данной реакции определяется селективностью процесса:
Реакция Скорость образования вещества D
Константа скорости данной реакции также определяется селективностью процесса:
Последовательные реакции первого порядка Рассмотрим реакцию, состоящую из двух последовательных стадий первого порядка:
Для вывода уравнений зависимости степени превращения веществ от времени потребуется составить материальный баланс:
Скорость первой реакции (считая ее протекающей по первому порядку):
Скорость образования продукта реакции:
или Решение этого дифференциального уравнения дает:
т.е. на кинетической кривой
Времени tmax отвечает максимальная концентрация промежуточного вещества В:
При при при Уравнения для констант скоростей реакций отвечают стандартным уравнениям первого порядка:
Сопряженные реакции По определению Н.А. Шилова, при протекании сопряженных процессов самопроизвольно идущая в системе реакция вызывает протекание другой реакции, не осуществимой в отсутствие первой. Две реакции, одна из которых индуктирует протекание другой, называются сопряженными. Сопряженную реакцию можно представить в виде схемы: Вещество А, реагируя с веществом В, дает вещество М: Вещество А без вещества В с веществом С не взаимодействует: При взаимодействии А, В и С образуются вещества М и N: Вещество А, которое участвует в обеих реакциях, называется актором. Вещество В, реагирующее с веществом А (актором) и индуцирующее реакцию А и С, называется индуктором. Вещество С, взаимодействие которого с актором возможно только при наличии химический индукции, называется акцептором. Количественная характеристика эффективности химической индукции называется фактором индукции:
Фактор индукции равен отношению скорости расходования акцептора к скорости расходования индуктора. Сопряженные реакции осуществляются в том случае, если промежуточные вещества первой стадии служат исходными для последующей стадии, вступая во взаимодействие с акцептором. В сопряженных химических реакциях энергия Гиббса, выделяемая при самопроизвольном процессе, в котором участвует актор, расходуется для протекания второй реакции, протекание которой сопровождается увеличением энергии Гиббса и без сопряженной реакции невозможна. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

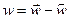
 ;
;
 .
.
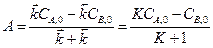

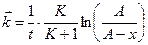






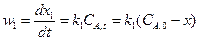 ;
;
 .
. ,
,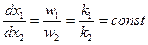 или
или 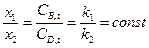
 называется селективностью реакции.
называется селективностью реакции. ‒ отношение концентрации целевого продукта к общей концентрации всех продуктов, полученных в результате процесса.
‒ отношение концентрации целевого продукта к общей концентрации всех продуктов, полученных в результате процесса.




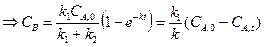




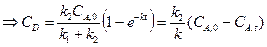


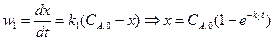 .
.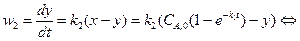

 ;
;

 для промежуточного вещества В должен быть максимум. Координаты этого максимума (
для промежуточного вещества В должен быть максимум. Координаты этого максимума ( 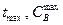 ) определяются из условия
) определяются из условия 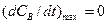 .
.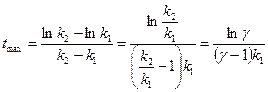 ,
,

 ,
,  , т.е. медленной первой стадии
, т.е. медленной первой стадии 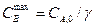 ;
; ,
,  , т.е. медленной второй стадии
, т.е. медленной второй стадии  ;
; ,
,  .
.
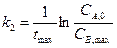
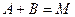 .
.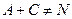 .
.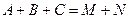 .
.