
|
|
Односторонняя реакция первого порядкаУравнение реакции: Кинетическое уравнение:
Из уравнения следует, что константа скорости реакции первого порядка имеет размерность Для характеристики скорости реакции первого порядка (и других порядков тоже) наряду с константой скорости часто пользуются временем полупревращения (полураспада) – промежутком времени, в течение которого реагирует половина взятого количества вещества (
Время полупревращения для реакций первого порядка не зависит от количества или концентрации исходного вещества и обратно пропорционально константе скорости реакции. Доля распавшегося вещества (степень превращения)
уравнение реакции первого порядка:
откуда следует, что доля оставшегося или распавшегося вещества моменту времени t не зависит от начального количества вещества. Для двух промежуточных значений
Если обозначить через а начальную концентрацию реагирующего вещества, через х – его количество, прореагировавшее за время t в единице объема, то
Вместо концентрации для реакций первого порядка можно использовать любые другие величины, пропорциональные концентрации. Односторонние реакции второго порядка Ситуация одного вещества или разных веществ одинаковой концентрации Уравнение реакции: Кинетическое уравнение:
Отсюда следует, что реакции второго порядка должны соблюдать прямолинейность в координатах 1/С ‒ t. При этом время полупревращения зависит от начальной концентрации:
Ситуация двух веществ с разной концентрацией Уравнение реакции: Кинетическое уравнение:
Получается уравнение с тремя переменными. При При После подстановки в дифференциальное уравнение:
Интегрирование уравнения в пределах от 0 до x и от 0 до t дает
Для количества прореагировавшего вещества х можно вывести уравнение:
Через степень превращения
Ситуация двух веществ, порядок по каждому реагенту = 1, суммарный порядок = 2 Уравнение реакции: Кинетическое уравнение:
При При
После интегрирования в пределах от 0 дох и от 0 до t:
Односторонние реакции третьего порядка Ситуация одного вещества или разных веществ одинаковой концентрации Уравнение реакции: Кинетическое уравнение:
Константа скорости третьего порядка имеет размерность (время)‑1 × (концентрация)‑2. Соответственно, выражение для времени полупревращения:
Ситуация разных веществ разной концентрации
Уравнение для скорости реакции:
Дифференциальное уравнение:
Уравнение времени полупревращения для реакций n порядка:
Определение порядка реакции и константы скорости реакции. Метод подстановки Этот метод заключается в подстановке экспериментальных данных в соответствующее кинетическое уравнение. В ходе реакции должно сохраняться (в пределах допустимых ошибок) постоянство константы для любых двух экспериментальных точек. Если постоянство константы не наблюдается при использовании любых из указанных выше уравнений, то реакция имеет более сложное кинетическое уравнение. Графический метод Порядок реакции можно установить, если графически определить, какая функция от концентрации линейно зависит от времени с наименьшим среднеарифметическим отклонением. При большом разбросе точек на всех графиках Метод времени полупревращения В общем виде при одинаковых начальных концентрация время полупревращения
Отсюда видно, что тангенс угла наклона прямой, выражающей зависимость Или порядок реакции можно вычислить по формуле:
при наличии экспериментальных данных времени полупревращения в двух параллельных сериях опытов с разной исходной концентрацией реагирующего вещества. Метод Вант-Гоффа Для медленно текущих реакций в первые моменты времени, когда x<<a, можно считать, что:
где
Тогда для двух опытов с разными начальными концентрациями имеем:
откуда после логарифмирования получаем:
Для совсем медленных реакций, когда
Метод избытка Для реакций, скорость которых зависит от концентрации нескольких компонентов, вычисляют частный порядок по данному компоненту, считая, что концентрация остальных веществ в ходе реакции, взятых в избытке, постоянна. Если реакцию A + B ® Продукты проводить сначала в условиях, когда концентрация исходного вещества В по сравнению с А избыточна, т.е.
Затем проводят реакцию при избытке вещества A по сравнению с B. Аналогично определяют частный порядок реакции по веществу B Сложные реакции Большинство реакций являются сложными и состоят из нескольких элементарных стадий. При рассмотрении кинетики сложных реакций делается допущение о независимом протекании элементарных стадий, т.е. что величина константы элементарной химической реакции не зависит от того, протекают ли в данной системе одновременно другие элементарные реакции. Как показывают расчетные и опытные данные, указанное допущение оправдывается в подавляющем числе реакций, с которыми приходится встречаться на практике. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
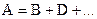
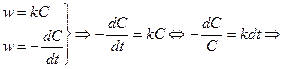
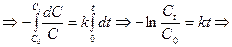
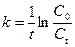
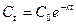
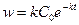
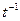 .
.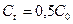 ). Для реакции первого порядка:
). Для реакции первого порядка: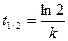
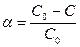
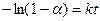
 при
при  и
и 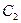 при
при 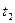
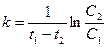 .
.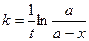 .
.

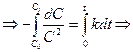
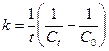

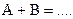 ;
; 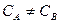
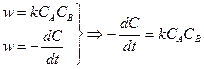
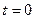 :
:  и
и 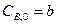
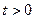 :
:  и
и 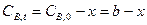 , т.к. коэффициенты в уравнении реакции единичные, то и расход обоих реагентов будет одинаковый.
, т.к. коэффициенты в уравнении реакции единичные, то и расход обоих реагентов будет одинаковый.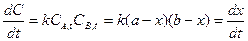
 , размерность (концентрация)‒1 × (время)‒1.
, размерность (концентрация)‒1 × (время)‒1.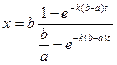
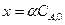 :
:
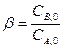
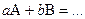
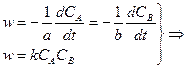
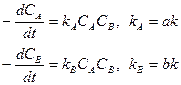
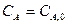 и
и 
 и
и 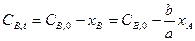 .
.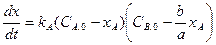
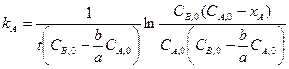
 или
или 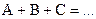
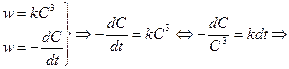
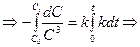

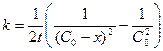
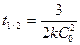 .
.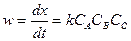
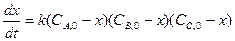
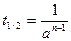
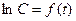 ,
, 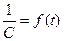 и
и  предпочтение отдается тому их них, где во-первых, наблюдается равномерный разброс точек по обе стороны от прямой, а, во-вторых, дисперсия R2 минимальна.
предпочтение отдается тому их них, где во-первых, наблюдается равномерный разброс точек по обе стороны от прямой, а, во-вторых, дисперсия R2 минимальна.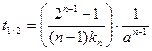

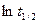 от
от 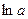 , равен
, равен 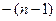 .
.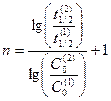
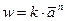
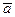 ‒ средняя концентрация вещества за время t:
‒ средняя концентрация вещества за время t: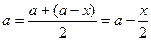 .
.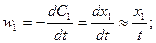
 ;
;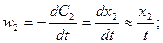
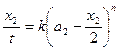 ;
;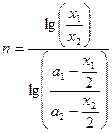
 и
и 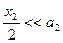
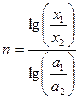 .
.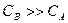 , ее можно ввести в постоянный коэффициент. Тогда кинетическое уравнение для скорости реакции будет
, ее можно ввести в постоянный коэффициент. Тогда кинетическое уравнение для скорости реакции будет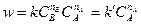 .
.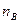 . Сумма таких частных порядков
. Сумма таких частных порядков 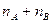 дает полный порядок реакции n.
дает полный порядок реакции n.