
|
|
Уравнение Нернста и направление протекания ОВР(термодинамика обратимых электрохимических систем) В электрохимических системах происходит взаимное превращение свободной энергии химических реакций и электрической энергии. Для термодинамически обратимой химической реакции, протекающей в электрохимической цепи при РТ = const, направление протекание реакции определяется изменением энергии Гиббса. Энергия Гиббса – это есть максимальная полезная работа системы, которая для электрохимического случая соответствует электрической работе (энергии) zFE, которую выполняет электрохимическая цепь. Следовательно
Через уравнение Гиббса-Гельмгольца можно определить другие термодинамические характеристики электрохимической системы:
откуда
Изменение ЭДС обратимых электрохимических цепей при различной температуре дает возможность = найти температурный коэффициент ЭДС = определить термодинамические характеристики электрохимических реакций Электрическая работа гальванического элемента (или энергия Гиббса, которая есть полезная работа) в общем случае не соответствует тепловому эффекту реакции. Если
Для реакции, протекающей в гальваническом элементе типа
Аналогично
Для одного и того же вещества в окисленной и восстановленной формах
Типы электродов Всего можно выделить 4 типа электродных систем. 1. Электроды 1 рода. Этот тип электродов образован простым веществом (металлом или неметаллом), погруженным в раствор своей соли. Металлическому электроду Ме|Меz+ соответствует реакция Меz+ + ze®Me и потенциал электрода описывается уравнением:
Неметаллическому электроду A|Az- соответствует электродная реакция A + ze ® Az- и потенциал электрода описывается уравнением:
Потенциал электрода первого рода зависит от активности лишь одного сорта ионов. 2. Электроды 2 рода. Такие электроды состоят из металла, покрытого слоем своей малорастворимой соли и погруженного в раствор, содержащий одноименные с этой солью анионы. Примером электрода второго рода может служить хлорсеребряный электрод, Ag, AgCl|KCl, потенциал которого зависит от содержания ионов Cl- в растворе. Однако, хлорсеребряный электрод нередко используют в качестве электрода сравнения при потенциометрических измерениях. В этом случае приэлектродное пространство заполняют насыщенным раствором хлорида калия, что обеспечивает стабильность значения электродного потенциала.
3. Газовые электроды состоят из инертного металла (Pt), контактирующего с газом и с раствором, содержащим одноименные с газом ионы. Самый известный пример газового электрода – водородный электрод: H+|H2,Pt. Для этого электрода реализуется реакция: H+ + e ® 1/2H2, для которой уравнение Нернста:
или
4. Окислительно-восстановительные электроды. Такая система состоит из компонентов, находящихся в растворе. В этом случае индикаторным электродом служит инертный металл (обычно платина или золото), который не принимает участия в реакции, а служит лишь передатчиком электронов между компонентами окислительно-восстановительной системы, поэтому только последние определяют величину потенциала электрода. Примером может служить платина, погруженная в раствор, содержащий Fe2+ и Fe3+. В этом случае на электроде протекает реакция Fe3+ + е Û Fe2+, потенциал которой будет определяться уравнением:
Электрохимические цепи Из обратимых электродов (полуэлементов) могут быть составлены обратимые электрохимические системы, называемые электрохимическими цепями (парами, гальваническими элементами). Различают два основных вида электрохимических цепей – химические и концентрационные. Химические цепи Химические цепи состоят из электродов, потенциалопределяющие реакции которых различны. Электрическая энергия возникает за счет энергии химической реакции, протекающей в цепи. Для химических цепей справедливы ранее установленные термодинамические соотношения между ЭДС и тепловым эффектом реакции, а также между стандартной ЭДС и константой равновесия реакции. Химические цепи разнообразны по природе и свойствам электродов, из которых они состоят. Для определения реакций, протекающих в химических цепях, следует поступать следующим образом. 1. Определить полярность электродов. Для этого надо сравнить потенциалы электродов. В первом приближении можно ограничиться сравнением стандартных электродных потенциалов. 2. Тот электрод, потенциал которого больше будет положительным (анод), электрод с меньшим потенциалом – отрицательным (катод). Например, для цепи
3. Уравнения потенциалопределяющих реакций на цинковом электроде: на серебряном электроде: 4. Суммарная реакция в цепи с учетом принципа электронейтральности:
5. ЭДС химических цепей определяется как разность потенциалов положительного и отрицательного электрода: Е=jК–jА, где jК и jА – потенциалы катода и анода. или Е = jox - jred, где jox – электрохимический потенциал «окислителя», более положительного электрода, jred – электрохимический потенциал «восстановителя», более отрицательного электрода. Работа аккумулятора Аккумуляторы относятся к вторичным химическим источникам электрического тока. Классический пример – свинцовый аккумулятор:
на электродах которого протекают токообразующие реакции:
Суммарная реакция:
Когда система работает как источник тока, реакция идет слева направо, на электродах образуется PbSO4. Они становятся одинаковыми электродами второго рода: Концентрационные цепи Концентрационные цепи состоят из электродов с одинаковыми потенциалопределяющими реакциями, которые отличаются друг от друга активностями участвующих в них веществ. В связи с этим концентрационные цепи делятся на две группы: 1) цепи, в состав которых входят два электрода с различной активностью ионов:
2) цепи с одним электролитом и с электродами, отличающимися по количественному составу, например, с амальгамными или газовыми:
Коррозия Самопроизвольное разрушение металлических материалов; происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать). К важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и коррозия в растворах электролитов (электрохимическая коррозия). Коррозия и газах происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др. К электрохимической коррозии относятся все случаи коррозии в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла и раствор в виде ионов. Термодинамический признак вероятности коррозии – энергия Гиббса протекания окислительно-восстановительной реакции типа Реакция возможна в прямом направлении, если Для процесса коррозии железа одной из наиболее важных полуреакций является:
При коррозии железа и стали на поверхности протекают следующие реакции: в кислой среде:
в щелочной среде:
Поскольку стандартные потенциалы для последних реакций больше Химическая кинетика Введение Для полного описания и последующего моделирования процесса необходима информация о: · вероятности и степени протекания процесса; · тепловом и массовом балансе; · времени протекания процесса; · механизме протекания процесса. На первые два пункта отвечает термодинамика, на третий и четвертый вопросы дает ответ кинетика. Кинетика – наука о химическом процессе, его механизме и закономерностях протекания во времени. При составлении кинетических зависимостей всегда надо знать тип химической реакции и иметь данные о ее механизме. Кинетикой химических реакций называется учение о скоростях реакций. В кинетике рассматриваются факторы, определяющие скорости реакций, а также промежуточные состояния, при помощи которых достигается конечный результат. Знание кинетических характеристик реакций и процессов необходимо для расчетов аппаратуры химической, металлургической и других отраслей промышленности. Химическая кинетика имеет большое научное значение, т.к. она дает наиболее общие методы выяснения механизма реакций, т.е. того, как отдельные столкновения и элементарные акты, включающие образование молекул, атомов, радикалов и ионов, совершаясь одновременно или последовательно, образуют в своей совокупности необходимый процесс. Основные понятия и определения Любая химическая реакция сопровождается разрывом химических связей. По типу разрывав связей реакции делятся на гомолитические и гетеролитические.
При гомолитическом разрыве химической связи электроны распределяются между атомами, образующими данную химическую связь. При гетеролитическом разрыве химической связи все электроны остаются у более электроотрицательного атома. В химических реакциях участвуют вещества в разных агрегатных состояниях. По агрегатному состоянию химические реакции принято делить на гомогенные, гетерогенные, гомофазные и гетерофазные.
Скоростью химической реакции называется скорость изменения количества участвующих в ней веществ в единицу времени. Величина скорости реакции имеет знак «+» для продуктов реакции и «–» для исходных веществ. Для гипотетической реакции aA + bB = eE
или в общем случае
Для реакций, протекающих в объеме V:
Для гетерогенных реакций, протекающих на поверхности S:
Таким образом, по скорости изменения концентрации только одного из реагирующих веществ можно определить скорость изменения концентрации остальных реагентов. Скорость химической реакции зависит от: · температуры, · концентрации реагирующих веществ, · давления, · степени дисперсности, · присутствия в системе катализатора. Элементарная стадия процесса – наиболее простая составная часть реакции. Состоит из отдельных актов химического превращения. Акт химического превращения – результат непосредственного взаимодействия и превращения частиц (атомов, молекул, ионов, радикалов…..). Все элементарные стадии являются обратимыми, могут протекать параллельно и последовательно. В ходе элементарных стадий образуются как промежуточные вещества, так и продукты реакции. При параллельном протекании реакции вещество (исходной или одно из промежуточных) расходуется разными путями на образование разных продуктов:
При последовательном протекании промежуточное вещество образуется в одной стадии и расходуется в другой:
Элементарные стадии реакции проходят через образование промежуточного или активированного комплекса. Активированный комплекс – такое состояние системы, в котором еще сохраняются старые химические связи и одновременно идет образование новых связей. Это уже не исходное вещество, но еще и не продукт реакции. Образованию активированного комплекса соответствует энергетически насыщенное состояние системы (энергетический максимум). Такое состояние термодинамически не устойчиво.
Профиль реакции с образованием активированных комплексов и промежуточного вещества Р. В элементарной стадии процесса может участвовать одна или несколько частиц. Число частиц, участвующих в элементарной стадии реакции называется молекулярностью реакции. Если в элементарной стадии участвует 1 частица – мономолекулярная реакция; 2 частицы – бимолекулярная реакция; 3 частицы – тримолекулярная реакция (вероятность такого события крайне мала). Молекулярность реакции можно оценить по значениям стехиометрических коэффициентов, если конечно известно уравнение реакции. Для примера представим, что следующие процессы являются элементарными реакциями:
Совокупность элементарных стадий является механизмом реакции. Если точный механизм установить невозможно, то говорят о наиболее вероятном механизме процесса. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
.

 ,
,



 , то электрическая работа меньше теплового эффекта реакции.
, то электрическая работа меньше теплового эффекта реакции.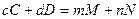 согласно уравнению изотермы:
согласно уравнению изотермы:

 – стандартная ЭДС гальванического элемента
– стандартная ЭДС гальванического элемента или
или 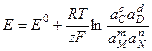


 .
. .
.
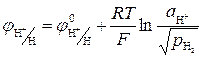
 .
.

 ;
; 


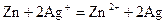
 ,
,

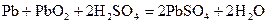
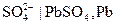 . ЭДС уменьшается и аккумулятор разряжается. Пропусканием тока в обратном направлении от внешнего источника тока система приводится в исходное состояние, аккумулятор заряжается. Повторение циклов разяд-разряд позволяет использовать аккумулятор длительное время.
. ЭДС уменьшается и аккумулятор разряжается. Пропусканием тока в обратном направлении от внешнего источника тока система приводится в исходное состояние, аккумулятор заряжается. Повторение циклов разяд-разряд позволяет использовать аккумулятор длительное время.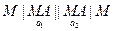
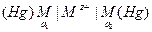
 , которая может быть оценена на основании значений стандартных электродных потенциалов.
, которая может быть оценена на основании значений стандартных электродных потенциалов. .
. ,
,  .
.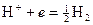 ,
,  и
и ,
, 
 ,
, 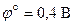
 , то это обеспечивает потенциальную возможность коррозии железа в присутствии влаг воздуха.
, то это обеспечивает потенциальную возможность коррозии железа в присутствии влаг воздуха.



 – количество вещества компонента реакции; t – время протекания процесса,
– количество вещества компонента реакции; t – время протекания процесса,  – стехиометрический коэффициент; для исходных веществ
– стехиометрический коэффициент; для исходных веществ  , для продуктов реакции -
, для продуктов реакции -  .
. , моль∙л−1∙с−1,
, моль∙л−1∙с−1, , моль∙м−2∙с−1
, моль∙м−2∙с−1


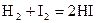 , тогда молекулярность реакции – 2.
, тогда молекулярность реакции – 2.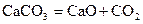 молекулярность реакции – 1.
молекулярность реакции – 1.