|
|
Двойной электрический слойПереход заряженных частиц через границу раствор – металл сопровождается возникновением на границе раздела двойного электрического слоя (ДЭС). Который и обеспечивает появление скачка потенциала. ДЭС создается электрическими зарядами, находящимися в поверхностном слое металла и ионами противоположного заряда (противоионами), ориентированными в поверхностном слое раствора. Этот двойной электрический слой можно сравнить с плоским конденсатором, одной обкладкой которого служит заряженная поверхность металла, а другой – внешняя граница ДЭС. В формировании ДЭС принимают участие: = электростатические силы, под влиянием которых противоионы подходят к поверхности электрода, = силы теплового движения, под действием которых ДЭС имеет размытую, диффузную структуру = силы специфической адсорбции поверхностно-активных ионов и молекул электролита.
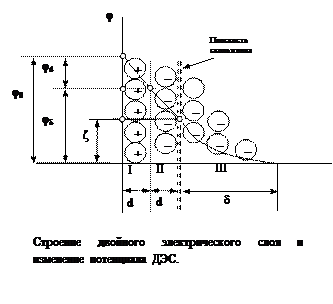
Первый слой состоит из потенциалопределяющих ионов – тех ионов, которые создают заряд поверхности φ0. Потенциалопределяющие ионы удерживаются на поверхности за счет сил хемосорбции. К потенциалопределяющим ионам за счет сил электростатического взаимодействия из раствора притягиваются противоионы, которые создают слой II и слой III. Слой II называется плотным слоем (слоем Штерна, слоем Гельмгольца). Внутри плотного слоя противоионы распределены равномерно. Плотный слой обычно имеет толщину порядка диаметра гидратированного иона d. Ионы плотного слоя примыкают к заряженной поверхности и связаны с нею двумя видами сил: адсорбционными и электростатическими. Эту часть ДЭС можно рассматривать, как плоский конденсатор, потенциал которого с увеличением расстояния от поверхности снижается линейно. Слой III называется диффузным (или слоем Гуи). Толщина диффузного слоя δ существенно больше (может больше 10 нм) и сильно зависит от концентрации электролитов. При высоких концентрациях электролитов или при введении многозарядных ионов δ мала и стремится к нулю. В пределе δ = 0 и частица не заряжена. В этом случае, противоионы адсорбционного слоя полностью компенсируют поверхностный заряд ядра. В результате достигается так называемое изоэлектрическое состояние, часто сопровождающиеся потерей агрегативной устойчивости системы. В слое Гуи ионы распределены не равномерно, связаны только за счет сил электростатического взаимодействия. По теории Гуи-Чепмена противоионы диффузной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Потенциал в диффузной части слоя снижается с расстоянием по экспоненте. При перемещении коллоидной частицы в дисперсионной среде ионы диффузного слоя могут отрываться. При отрыве ионов диффузного слоя возникает электрокинетический или ζ-потенциал. Гипотетическая поверхность отрыва ионов диффузного слоя называется плоскостью скольжения. Механизмов (способов) образования ДЭС несколько. 1. Обменный механизм. Обмен ионами между электродом и раствором электролита. Картинка 2. Специфическая адсорбция (хемосорбция). Представляет собой накопление на поверхности электрода ионов под влиянием химических сил, например, по принципу образования осадка. Здесь к сорбции большую склонность проявляют анионы. Картинка 3. Адсорбция полярных молекул ПАВ или диполей воды. Картинка 4. Появление контактного потенциала здесь электронный газ в металле выходит за границы кристаллической решетки и на поверхности металла появляется отрицательный заряд, а внутри – избыточный положительный. Картинка В создании потенциала электрода участвуют все возможные для данного электрода типы ЭДС. Изменения в строении ДЭС не влияют на величину равновесного потенциала, при условии, что химические потенциалы веществ, входящих в состав электродной системы остаются постоянными. При увеличении вклада одного ДЭС, вклад других соответственно уменьшится. Потенциал нулевого заряда Скачок потенциала, отвечающий двойному электрическому слою при незаряженной поверхности металла, называется потенциалом нулевого заряда. Потенциал нулевого заряда определяется природой металла и составом электролита. При адсорбции катионов ПНЗ становится более положительным, при адсорбции анионов – более отрицательным. ПНЗ является важной характеристикой электродов при описании неравновесных процессов на электродах – процессов электролиза, т.к. его величина существенно влияет на кинетику электролиза. Стандартные потенциалы К сожалению, непосредственно измерить потенциал какой-либо системы пока не представляется возможным. Мы можем измерить только разность потенциалов или ЭДС гальванической системы, состоящей из пары электродов. В связи с этим было введено понятие водородного электрода и шкалы стандартных электродных потенциалов. Потенциал водородного электрода условно принят равным нулю и относительно него были измерены потенциалы всех возможных электродных систем. В силу того, что потенциал электрода зависит от температуры и концентрации раствора было принято привести значения электродных потенциалов к единым условиям, получивших название стандартных: температура 298 K и концентрация раствора 1 моль/кг (если речь идет о газовых электродных системах, то давление 1 атм). Зависимость потенциала электрода от температуры и состава раствора в общем случае описывается при помощи уравнения Нернста. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|