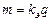|
|
Определение константы диссоциацииДля этого получают зависимость удельной электропроводности слабого электролита от его концентрации. Рассчитывают значения эквивалентной электропроводности для каждой концентрации. Вычисляют значение константы диссоциации по формуле:
или
Определение растворимости
Кондуктометрическое титрование. Кондуктометрическое титрование используется при определении индивидуальных веществ и анализе разнообразных смесей. Удельную электропроводность измеряют после каждой порции титранта. Зависимость электропроводности раствора от количества добавленного титранта изображают графически. Полученный график называют кривой кондуктометрического титрования. Кондуктометрические кривые имеют излом, соответствующий точке эквивалентности. К преимуществам метода кондуктометрического титрования относится возможность дифференцированного определения веществ в многокомпонентных смесях в водных растворах. Другим преимуществом метода является возможность определений в окрашенных и мутных растворах, а также в присутствии окислителей и восстановителей, ограничивающих применение других методов.
Виды кривых кондуктометрического титрования. I – титрование раствора сильной кислоты сильным основанием; II – титрование раствора слабой кислоты сильным основанием; III – титрование смеси сильной и слабой кислот сильным основанием; IV – кривая окислительно-восстановительного титрования.
Термодинамика электродных систем Введение Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из следующих частей: 1. Проводники первого рода – вещества, обладающие электронной проводимостью, находящиеся в контакте с электролитом. 2. Проводники второго рода – вещества, обладающие ионной проводимостью или электролиты. На границе раздела двух фаз (между проводниками обоих родов) происходит перенос электрического заряда, т.е. протекает электрохимическая реакция. Система из двух проводников I и II рода – электрод. По направлению процесса взаимного превращения электрической и химической форм энергии различают две группы электрохимических систем.
Схематическое изображение электрохимических систем
При электролизе за счет внешней электрической энергии (рис. a) в системе возникают химические превращения – процессы восстановления и окисления – протекающий на электродах. В химическом источнике электрического тока (рис. b) – гальваническом элементе – энергия химического процесса переходит в электрическую опять же за счет окислительно-восстановительных процессов на электродах. В любом случае происходит протекание электрического тока по электрохимической цепи. В электрохимии реакции восстановления принято называть катодными, окисления – анодными. В соответствии с характером реакций, протекающих на электродах, их называют катодом и анодом. При протекании постоянного электрического тока через электрохимические системы на электродах протекают электрохимические реакции. Закон Фарадея Соотношение между количеством электричества и массами прореагировавших веществ выражается законами Фарадея. 1 закон. Масса вещества, претерпевшего химическое превращение под действием электрического тока, пропорциональна количеству протекшего электричества:
kэ – электрохимический эквивалент – масса прореагировавшего вещества при протекании единицы количества электричества, г/Кл = г/Ач 2 закон. При прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны их эквивалентным массам:
Для электрохимического превращения 1 эквивалента любого вещества требуется одинаковое количество электричества F, называемое числом (постоянной) Фарадея. Уравнение, объединяющее оба закона Фарадея:
Законы Фарадея являются общими и точными законами электрохимии. Однако при электрохимических процессах часто наблюдаются отклонения от этих законов: масса действительно полученного или разложившегося продукта не соответствует теоретической. Отклонения возникают за счет одновременного протекания побочных электрохимических процессов, химических реакций, в которые вступает продукт, и его потерь. Эффективность электрохимического процесса оценивается выходом по току

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|