
|
|
Историческая справка о природе растворов электролитовПервые представления о переносе электрического заряда в растворах были высказаны в трудах Гроттуса (1805 г.). Основная идея – эстафетный перенос заряда от одной молекулы воды к другой под действием приложенной разности потенциалов. Молекула воды при контакте с электродом теряет заряд – в зависимости от знака заряда электрода «плюс» или «минус». Далее этот заряд передается как бы по эстафете от молекулы к молекуле. Продолжение теория Гроттуса получила в ионных теориях электропроводности Фарадея (1833 г.) и Клаузиуса (1857 г.). Клаузиус, в частности показал, что выполнение закона Ома для растворов электролитов даже при самых низких напряжениях на измерительных электродах свидетельствует о постоянно существующих переносчиках заряда в растворе электролита. Вант-Гофф попытался распространить теорию идеальных растворов на растворы электролитов. Для этого он ввел в уравнение осмотического давления коэффициент i (осмотический коэффициент В-Г), физический смысл которого долгое время оставался неясным. Коэффициент В-Г был введен и в другие уравнения, описывающие свойства идеальных растворов с целью сделать их пригодными к применению для растворов электролитов (1877 г., Планк, 1-й номер ЖФХ). Там же и тогда же. Аррениус предложил, что при растворении веществ в растворителе происходит их частичное разложение (диссоциация), результатом которого является появление в растворе заряженных частиц или ионов. Аррениус ввел понятие степени диссоциации, которое является мерой диссоциации, и которое он отождествлял с понятием коэффициент активности. Авторское определение: «отношение числа ионов, действительно существующих в растворе электролита, к числу ионов, которое получилось бы при полном распадении электролита на простые электростатические молекулы». Предположения Клаузиуса, Вант-Гоффа, Планка и Аррениуса считаются основой современной теории электролитической диссоциации, которая определяется собственно двумя положениями: = гипотезой электролитической диссоциации Аррениуса и = связью степени диссоциации с концентрацией электролита в растворе через закон действия масс (закон разведения Оствальда):
Сразу после опубликования теория Аррениуса вызвала ряд возражений. В числе именитых противников – Менделеев, Коновалов, Бекетов и др. Менделеев: не все реакции в растворах идут с участием ионов; они могут быть реализованы при взаимодействии нейтральных молекул, например, хлористые соли могут образовываться из растворов, где соляная кислота диссоциирована (водные среды) и не диссоциирована (бензольные растворы). Многие электролиты поглощают свет пропорционально их концентрации, хотя по теории Аррениуса такой пропорциональности быть не может. Менделеев сомневался, могут ли в растворе возникать такие силы, которые вызывают разложение таких прочных соединений, как хлориды натрия или калия. Коновалов: причиной электропроводности растворов электролитов является не диссоциация, а наоборот, ассоциация. Еще к недостаткам теории Аррениуса. В некоторых системах молекулы растворенного вещества не диссоциируют на катионы и анионы, а ионизируются, т.е. распадаются на катион и «свободный» электрон. Пример – растворы некоторых металлов (щелочных, щелочноземельных, редкоземельных) в жидком аммиаке. Электропроводность подобных растворов с ростом концентрации увеличивается почти экспоненциально! Компромиссом между различными взглядами на теорию растворов электролитов стало разделение электролитов на сильные и слабые. Слабые электролиты подчиняются теории Аррениуса, сильные – практически нет. Полностью же увязать в единую теорию все взгляды прошлого и современности на процессы в растворах электролитов по-прежнему не удается. О сольватации и ассоциации Ассоциация = тенденция молекул чистой жидкости или раствора к упорядоченному расположению. = взаимодействие между однородными молекулами, приводящее к образованию молекулярных соединений – устойчивых комплексов или ассоциатов. Явление ассоциации на данный момент времени изучено недостаточно. Точно известно различие между нормальными, неассоциированными и ассоциированными жидкостями. Ассоциацию измеряют при помощи показателя ассоциации. Для определения показателя ассоциации число одиночных молекул делят на число реально существующих молекулярных групп. В большинстве случаев показатель ассоциации вычисляется на основе отклонений свойств исследуемой жидкости от тех ее свойств, которые она предположительно имела бы, если была бы нормальной, неассоциированной. Долгое время, например, считалось, что вода представляет собой набор состава H2O; (H2O)2 и (Н2О)3. Не подтверждается пока. По современным представлениям в ассоциированных жидкостях силы, действующие между молекулами, имеют определенное направление в пространстве и локализованы в отдельных частях молекулы. Если частицы жидкости не обладают такими направленными и локализованными силами взаимодействия друг с другом, то жидкость ведет себя как «нормальная», т. е. является неассоциированной. Примером ассоциированных жидкостей могут служить вода, спирты, органические кислоты и другие жидкости, молекулы которых обладают способностью образовывать друг с другом водородные связи. Примером неассоциированных жидкостей служит СCl4 Тип ассоциации зависит от числа эффективных связей, которые могут быть образованы одной молекулой. Если число связей равно единице, то ассоциация сводится к образованию бимолекулярных комплексов. Если число связей равно двум (вода, спирты, фтороводород), то ассоциированные комплексы могут образовываться в виде замкнутых колец, или открытых цепей. Такой случай ассоциации по-видимому имеет место и среди карбоновых кислот.
Теоретически явления ассоциации ионов наиболее полно обосновано В.К.Семенченко (1924 г.) и Бьеррумом (1926 г.). Явление ассоциации объясняется кулоновским взаимодействием между ионами. Если электростатическое взаимодействие между ионами превышает кинетическую энергию, то ионы уже не способны к самостоятельному движению. Они образуют частицы, состоящие из двух и более ионов, и ведут себя как отдельные самостоятельные конгломераты. Если величина электростатического взаимодействия
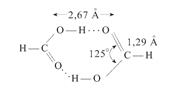
Для данного растворителя при постоянной температуре граница будет определяться величиной расстояния r и диэлектрической проницаемостью растворителя. Если r велико, то Увеличение концентрации приводит к уменьшению расстояния между ионами, следовательно к росту степени ассоциации. Уменьшение диэлектрической проницаемости приводит к увеличению кулоновского взаимодействия, а следовательно, процесс ассоциации будет начинаться при более низкой концентрации растворенного вещества. Сольватация По современным представлениям ионы в растворе сольватированы, т.е. окружены определенным числом ориентированных диполей растворителя, которые прочно удерживаются вблизи иона и участвуют в тепловом движении вместе с ионом. Энтальпия и энергия Гиббса сольватации ионов по абсолютной величине тем больше, чем выше заряд иона и меньше его размер. Кроме сольватации важным фактором, приводящим к диссоциации электролита, является способность молекул растворителя образовывать разного типа связи с частицами электролита. Как пример – водородные связи. Сольватация – взаимодействие между разнородными молекулами, приводящее к образованию молекулярных соединений. Представление о сольватации возникло на основе теории растворов Менделеева. Строение растворов Менделеев представлял через образование непрочных гидратов типа A∙nH2O, для которых величина n – переменная и может меняться от одних растворов к другим; кроме того образования типа A∙nH2O могут по ходу дела разрушаться и вновь образовываться. Менделеев считал водные растворы совокупностью ряда неустойчивых, превращающихся друг в друга химических соединений или гидратов. Впоследствии термин «гидрат» был заменен более общим термином «сольват», применимым не только к водным, но и к неводным растворам. Менделеев подчеркивал, что представление о растворах как о совокупности неустойчивых химических соединений, позволяет привести представление о растворах к понятию об определенных соединениях. Современные представления о растворах допускают существование в растворах относительно устойчивых молекулярных групп типа гидратов или сольватов. Необходимо иметь в виду также возможность существования изомерных сольватных комплексов, одинаковых по составу и числу молекул, но различных по своему строению. Например, тринитробензол С6H3(NO3)3 с нафтиламином C10H7NH3 образует два вида комплексов:
В первом случае сольватация происходит за счет того, что группа NO3, обладающая большим дипольным моментом, индуцирует в ароматическом кольце диполь. Во втором случае связь образуется за счет притяжения друг к другу диполей в группах NO3 и NH3 (дипольное взаимодействие). В процессе теплового движения тенденция к упорядоченному распределению приводит к тому, что молекулярные группы типа гидратов и сольватов появляются чаще и живут дольше, чем какие-либо другие группы. Они наиболее вероятны и наиболее устойчивы. Но вместе с тем нет оснований считать раствор состоящим только из гидратных или сольватных групп. Возможны и многие другие комбинации. Во многих растворах сольваты вообще не образуются (бензол-толуол, метанол-этанол). Сольватационные эффекты обычно имеют существенное значение при растворении электролитов в полярных жидкостях. Во многих случаях эти эффекты настолько ярко проявляются, что некоторая часть молекул растворителя полностью связывается и в дальнейшем ведет себя как единое целое с ионом или молекулой растворенного вещества. Определенная степень сольватации имеет место во всех, особенно в полярных растворителях. Чаще всего, однако, приходится сталкиваться в процессом сольватации в воде или процессом гидратации. Растворение любого вещества в воде (или другом растворителе) приводит к возмущению и электронного состояния молекул или атомов растворителя. Причиной является процесс поляризации молекул растворителя под действием молекулы или атома растворенного вещества. Разность энергий конечного и начального состояний растворителя представляет собой т.н. энергию реорганизации. Сумма эффектов электронного возмущения для растворителя и растворенного вещества – сольватационный эффект. Частным случает сольватационного эффекта является гидратационный эффект. По своей природе процессы (эффекты) гидратации подразделяют на гидрофобные и гидрофильные. Гидрофобные эффекты гидратации характеризуются тем, что молекулы растворенного вещества своими гидрофобными группами как бы усиливают связь между молекулами растворителя, происходит упрочнение водородных связей молекул воды и структурное упорядочение растворителя. Как следствие этого при смешивании компонентов раствора наблюдается уменьшение объема и выделение тепла при образовании раствора. Гидрофильный процесс гидратации наблюдается у веществ с достаточно высоким сродством к воде. Он характерен сильным электрическим полем растворенной молекулы или иона. В результате молекулы растворителя образуют с молекулой или ионом растворяемого вещества сольватный комплекс. Взаимодействие растворителя с растворяемым веществом сопровождается изменением энтальпии
где H – полная энтальпия образовавшегося раствора; Н1 и Н2 – энтальпии 1 моль растворителя и растворяемого вещества в чистом состоянии и n1 и n2 – числа молей растворителя и растворенного вещества в растворе. Полное изменение энтальпии при растворении n2 молей растворенного вещества в n1 молях растворителя называется интегральной теплотой растворения ΔsolvH. Интегральная теплота растворения зависит от концентрации, поэтому, как правило, в справочной литературе приводят так называемую первую интегральную теплоту растворения, которая соответствует теплоте растворения n2 молей растворенного вещества в бесконечно большом количестве растворителя. Теплоты растворения служат основанием для качественных характеристик взаимодействия в растворе при изменении его концентрации, а также позволяют провести классификацию веществ с точки зрения тепловых эффектом при образовании раствора, например. 1951 г. Мищенко и Сухотин. Понятие характерной концентрации – граница полной гидратации. При концентрации растворяемого вещества = ГПГ координационное число ионной гидратации для сильных электролитов остается постоянным до тех пор, пока воды в растворе достаточно, и вся наличная вода включена в гидратную сферу. Если понимать сольватацию как сумму всех процессов, возникающих при появлении в растворителе частиц растворяемого вещества, то при бесконечном разведении в случае образования раствора кристаллического электролита (был ионным кристаллом до растворения, типа NaCl) будет формально справедливо уравнение:
где ΔН0 – первая интегральная теплота растворения; ΔНреш – изменение энтальпии при взаимном удалении ионов от расстояний в решетке до бесконечности (энергия решетки); В итоге первые теплоты растворения имеют для большинства электролитов сравнительно небольшие значения, в пределах от -160 до +60 кДж/моль. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
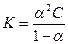
 больше кинетической энергии ионов
больше кинетической энергии ионов  , то происходит образование ионных пар или квазимолекул. Граничным условием возникновения ассоциации является равенство кинетической энергии и энергии электростатического взаимодействия:
, то происходит образование ионных пар или квазимолекул. Граничным условием возникновения ассоциации является равенство кинетической энергии и энергии электростатического взаимодействия: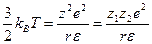
 , а если r мало, то
, а если r мало, то  и происходит взаимодействие между ионами.
и происходит взаимодействие между ионами. и
и 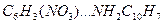
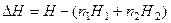
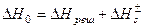
 – суммарная химическая теплота сольватации (гидратации) положительных и отрицательных ионов, показатель процесса растворения электролита в целом, не показывает энергию сольватации каждого иона в отдельности. ΔНреш и
– суммарная химическая теплота сольватации (гидратации) положительных и отрицательных ионов, показатель процесса растворения электролита в целом, не показывает энергию сольватации каждого иона в отдельности. ΔНреш и