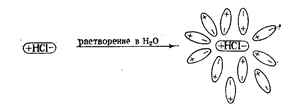|
|
Кристаллизация соли АХ сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
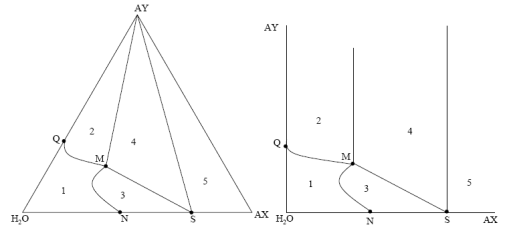
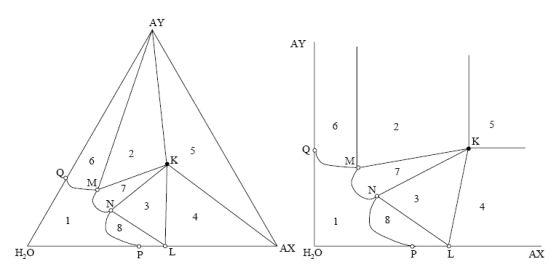
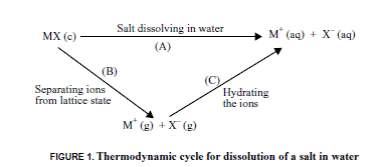
На треугольной диаграмме растворимости солей АХ и AY составу такого кристаллогидрата отвечает точка, лежащая на стороне треугольника между вершинами АХ и Н2О – точка S (AX∙nH2O). Поскольку при кристаллизации 1 моля соли АХ связывается в кристаллогидрат п молей воды, равновесное сосуществование трех фаз: раствора, кристаллов АХ∙nН2О и кристаллов AY, возможно лишь при составах, включающих необходимый минимум воды, не участвующей в образовании кристаллогидрата. Эти составы отвечают области 4. Область 5 отвечает трем твердым фазам: кристаллам АХ, AY и S. На диаграмме в прямоугольных координатах точка Sна абсциссе отвечает такому содержанию соли АХ на 100 молей воды, когда вся вода израсходована на образование кристаллогидрата. Область 1 отвечает ненасыщенным растворам солей АХ и AY,а линии, ограничивающие эту область, насыщенным растворам этих солей. Область 2 представлена двумя фазами: кристаллами AY и равновесными с ними насыщенными растворами, а область 3 соответствует насыщенным растворам и равновесным с ними кристаллам АХ∙nН2О. В области 4 в равновесии с насыщенным раствором состава Mнаходятся кристаллы АХ∙nН2О и AY. Кристаллизация соли АХ сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
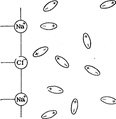
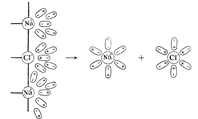
1 – раствор 2 – ЖМ + AY + AX∙AY∙H2O (K) 3 – ЖN + AX∙H2O (L) + K 4 – L + AX + K 5 – AX + AY + K 6 – AY + ЖQM 7 – K + ЖMN 8 – L + ЖNP Электрохимия Введение Электрохимия – раздел физической химии, в котором изучаются = процессы взаимного превращения химической и электрической форм энергии, = системы, в которых совершаются взаимные превращения химической и электрической форм энергии, = физико-химические свойства ионных проводников, = процессы и явления на границе раздела фаз с участием заряженных частиц – ионов и электронов. Электрохимические системы рассматривают с 2 позиций: = в равновесных условиях (ток отсутствует или его количество бесконечно мало) – термодинамика электрохимических процессов; = в неравновесных условиях (при наличии измеримого количества тока) – кинетика электрохимических процессов. Изучаемые темы по электрохимии: = теория растворов электролитов; = электропроводность; = теория равновесных электродных процессов; = строение двойного электрического слоя на границе раствор – металл; = теория электродных процессов, протекающих в неравновесных условиях (особенности процессов электролиза). Историческая справка о науке электрохимии Возникновение электрохимии как науки относится к рубежу XVIII и XIX вв. и связано с работами Л.Гальвани, А.Вольта, В.В.Петрова, Г.Дэви. 1833 г. М.Фарадей – законы электролиза; 1887 г. С.Аррениус – положения теории электролитический диссоциации; 1890 г. Нернст – теория возникновения электродного потенциала. XX в – теория растворов электролитов (П.Дебай + Э.Хюккель + Л.Онзагер), теория двойного электрического слоя (Ж.Гуи, Д.Чапмен, О.Штерн, А.Фрумкин), электрохимическая кинетика (А.Фрумкин + Фольмер). Растворы электролитов Основные понятия и определения Электролитами называются вещества, которые в растворе или в расплаве самопроизвольно (частично или полностью) распадаются на ионы. Ион – заряженная частица, способная к самостоятельному существованию. Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита. Раствором электролита называется неметаллическая жидкая смесь, способная переносить электрический заряд. Для раствора электролита соблюдается правило электронейтральности. В соответствии с правилом электронейтральности, сумма положительных зарядов равна сумме отрицательных зарядов. В кристаллах с ионной связью ионы располагаются в узлах кристаллической решетки. Например, кристаллы хлорида натрия NaCl состоят из ионов Na+ и Cl−. При попадании кристалла хлористого натрия в воду ионы натрия и хлора переходят в раствор в результате их взаимодействия с молекулами воды. В растворе получаются гидратированные ионы . Схема ориентации молекул воды в электростатическом поле, создаваемом ионами хлорида натрия.
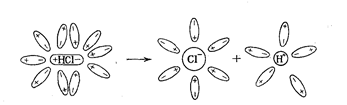
Схема отрыва ионов натрия и хлора от кристалла хлорида натрия и гидратации этих ионов.
При растворении полярных веществ в растворителях, имеющих высокую диэлектрическую проницаемость (растворителях полярных), происходит ослабление и разрыв связей между атомами в молекулах растворяемого вещества, что приводит к образованию ионов. Например, при растворении в воде соляной кислоты под действием молекул воды происходит диссоциация полярных молекул HCl на ионы и гидратация их в растворе.
Схема гидратации и деформации молекул с полярной связью.
Схема электролитической диссоциации молекул с полярной связью. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|