
|
|
Третий закон термодинамикиК концу XIX века вопросы расчетов химического равновесия стали приобретать важное практическое значение. Дело в том, что значение константы равновесия невозможно вычислить только на основании термических данных. Приходится осуществлять равновесие при одной температуре, исследовать его, вычислять значение константы равновесия для этой температуры и находить далее значение константы интегрирования. Другими словами, для вычисления константы равновесия надо предварительно осуществить само равновесие. Только после такой процедуры можно определить константу равновесия при любой другой температуре. Ле Шателье поставил задачу определения константы равновесия без проведения предварительного эксперимента. Однако решить такую задачу в рамках первого и второго законов термодинамики невозможно. Если эта задача вообще решаема, то должен существовать метод определения энтропии без осуществления равновесия. Томсен в 1852 г. и Бертело в 1869 г. сделали попытку решить поставленную проблему. Обоих исследователей интересовал критерий, которому должны подчиняться самопроизвольно протекающие химические реакции. По Томсену и Бертело на языке современной термодинамики таким критерием является изменение энтальпии при реакции, которое при постоянных давлении и температуре должно быть отрицательным, т. е.
Однако это неравенство может быть эквивалентным неравенству Однако при низких температурах, приближающихся к абсолютному нулю, принцип Бертело–Томсена полностью справедлив. Выполнение этого принципа при низких температурах навело Нернста на мысль о том, что ΔG и ΔН не только равны друг другу при абсолютном нуле, но и зависимости ΔG(T) и ΔН(Т) имеют общую касательную при этой температуре. Продифференцируем уравнение ΔG = ΔН – TΔS по температуре при постоянном давлении:
Получим
По предположению Нернста (1906), поскольку и квантовая теория, и экспериментальные данные свидетельствуют о том, что величина Ср превращается в нуль при абсолютном нуле:
Уравнения являются математической записью третьего закона термодинамики. Часто Трудность использования этого закона состоит главным образом в том, что конденсированная фаза должна быть чистой и строго равновесной, т. е. в состоянии с минимальной энергией. Если произошло какое-либо нарушение фазы, например нарушение идеальности решетки или внедрение посторонних атомов в кристаллическую решетку, то система перейдет в состояние неполного равновесия, и ее энтропия даже при Т = 0 будет больше нуля. Это так называемая остаточная энтропия. Остаточная энтропия в смешанных кристаллах, состоящих из двух изотопов какого-либо элемента, возникает потому, что атомы занимают узлы кристаллической решетки более хаотично, а не так, чтобы достигалось состояние с минимальной энергией. Так, при соотношении изотопов 1:1 остаточная энтропия смешанных кристаллов составляет примерно 5,8 Дж/моль. Постулат Планка используют для вычисления абсолютных значений энтропии (абсолютных энтропии). Для вычисления абсолютной энтропии необходимо знание теплоемкости, определенной до возможно более низких температур. Так как теплоемкости при 0 К не известны ни для одного из веществ, то эти величины находят экстраполяцией уравнения Дебая с помощью эмпирических приемов. Необходимо, однако, подчеркнуть, что для практического осуществления химической реакции необходимо располагать данными не только о возможности, но и скорости ее протекания. Последнее определяется на текущий момент времени из эксперимента. Если скорость химической реакции окажется очень малой, то в этом случае термодинамическая возможность реакции не реализуется. Для практического осуществления медленной реакции необходимо =Подобрать катализатор для увеличения скорости =Условия – для хорошего выхода целевого продукта На основе термодинамических и кинетических данных определяется устойчивость индивидуальных веществ. Если для индивидуального вещества Термодинамически неустойчивое вещество может быть устойчивым кинетически – мала скорость распада (бензол). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

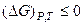 только в том случае, если изменение энтропии при реакции равно нулю. Но поскольку ΔS в общем случае не равно нулю, то неравенство
только в том случае, если изменение энтропии при реакции равно нулю. Но поскольку ΔS в общем случае не равно нулю, то неравенство 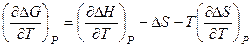 , учтем
, учтем 
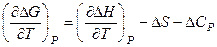
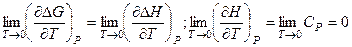

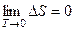
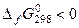 , то оно будет термодинамически устойчиво. Если
, то оно будет термодинамически устойчиво. Если 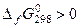 , то термодинамически неустойчиво.
, то термодинамически неустойчиво.