
|
|
Первый закон термодинамикиПри помощи первого начала решается первая задача термодинамики – расчет теплового эффекта, количества теплоты, теплового баланса. Математически первое начало термодинамики
Изменение внутренней энергии системы равно сумме количества выделившейся или поглощенной теплоты и совершенной системой работы
Тепло, подведенное к системе, тратится на совершение работы и изменение внутренней энергии системы. В уравнении перед символами теплоты Q и работы W стоит знак δ, отображающий некие конечные приращения этих величин, а перед символом U – внутренней энергии – знак d, свидетельствующий о том, что внутренняя энергия является функцией состояния, которая не зависит от пути процесса. В связи с этим в термодинамике принято разделять все термодинамические функции на две категории – функции состояния и функции процесса. Совершенно очевидно, что функции состояния – это функции, дифференциал которых является полным дифференциалом, а функции процесса – это функции, дифференциал которых не является полным дифференциалом. Признак Эйлера для определения функции состояния Признак, по которому можно определить, является ли данная функция функцией состояния или функцией процесса был предложен Эйлером. Для системы, описываемой функцией двух переменных, можно записать соотношение
Обозначим Если если Применение первого закона термодинамики к процессам в идеальных газах Если учитывать только работу расширения газа dW = PdV, то первое начало термодинамики можно записать в виде:
Изохорный процесс V = const, следовательно dV = 0, следовательно В изохорном процессе вся теплота расходуется на изменение внутренней энергии системы и приобретает свойства функции состояния. Изобарный процесс P = const, следовательно, Величина Изменение работы при изобарном процессе определяется формулой:
и тоже является функцией состояния. Работа, выполненная системой в изобарном процессе В изобарном процессе теплота расходуется на совершение работы и изменение внутренней энергии системы. Изотермический процесс В этом случае изменение внутренней энергии Следовательно, Вся теплота идет на совершение работы. В данном случае – работы расширения. По уравнению Менделеева-Клапейрона (для 1 моль газа)
Тогда
и
Адиабатный процесс Q = const, следовательно,
следовательно, работа совершается за счет убыли внутренней энергии:
По уравнению Менделеева-Клапейрона (для 1 моль газа)
Тогда
Отсюда
где Выражения для зависимости теплоты и работы от параметров системы – давления P, объема V и температуры Т для основных состояний идеального газа приведены в таблице:
Теплоемкость Средней теплоемкостью системы называют количество тепла, отнесенное к вызванному им повышению температуры системы:
Если эта величина отнесена к единице массы, говорят об удельной теплоемкости, если к молю – о мольной теплоемкости. В дальнейшем, если иное не оговорено, речь будет идти о последней. Так как теплоемкость довольно существенно меняется с изменением температуры, обычно используют и табулируют не среднюю теплоемкость, зависящую как от исходной температуры Т1 так и от конечной Т2 а производную от теплоты по температуре при данной температуре Т, называемую истинной или просто теплоемкостью:
Знак неполного дифференциала
На основе этих определений можно рассчитать количество теплоты, необходимое для изобарного нагревания 1 моль вещества от температуры Т1 до Т2:
и получить связь между средней и истинной теплоемкостью;
Так как при изобарном нагревании теплота расходуется не только на увеличение внутренней энергии, но и на совершение работы расширения, Ср практически всегда больше Сv, причем их разность тем больше, чем больше при нагревании расширяется вещество:
Таким образом, универсальная газовая постоянная в физическом смысле – это максимальная работа расширения, которую может совершить 1 моль идеального газа при изобарном нагревании его на 1 K, т. е. это, так сказать, «работоемкость» 1 моль идеального газа. Реальные газы приближаются по своим свойствам к идеальному по мере повышения температуры, понижения давления, т.е. уменьшения межмолекулярного взаимодействия и размера молекул газа. Законы идеального газа дают удовлетворительную точность расчетов для большинства газов при обычных температурах и давлении до нескольких десятков атмосфер. Конденсированные тела (жидкости и кристаллы) расширяются при нагревании приблизительно на порядок меньше, чем газы. Поэтому при грубых оценках разностью между Сp и Cv просто пренебрегают или принимают ее равной 1 Дж/мольК. В инженерных расчетах обычно имеют дело с изобарной теплоемкостью, в то время как теоретические соображения чаще приводят к изохорной теплоемкости, которую затем пересчитывают в изобарную. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|


 .
.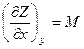 и
и 
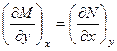 , то функция является функцией состояния,
, то функция является функцией состояния, – то не является и ее дифференциал – не полный дифференциал.
– то не является и ее дифференциал – не полный дифференциал. .
. или
или 
 .
. называется энтальпией, обозначается H. Является расширенной внутренней энергией системы, т.к. непосредственно связана с внутренней энергией и является полным дифференциалом, следовательно она – функция состояния. Следовательно, количество теплоты при изобарном процессе – тоже функция состояния.
называется энтальпией, обозначается H. Является расширенной внутренней энергией системы, т.к. непосредственно связана с внутренней энергией и является полным дифференциалом, следовательно она – функция состояния. Следовательно, количество теплоты при изобарном процессе – тоже функция состояния.
 .
. , т.к. T = const.
, т.к. T = const. или
или  .
. отсюда
отсюда 


 ,
, или
или  .
.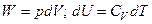

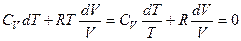
 ,
,







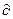 , использованный здесь, говорит, что теплота не является свойством системы, а зависит от пути процесса и его обратимости. Так, например, понятие теплоемкости теряет смысл для изотермических процессов, агрегатных превращений или процессов, сопровождающихся совершением какой-либо иной работы, кроме работы расширения. Обычно в процессах изобарного или изохорного нагревания используют изобарную (Ср) или изохорную (Сv) теплоемкость.
, использованный здесь, говорит, что теплота не является свойством системы, а зависит от пути процесса и его обратимости. Так, например, понятие теплоемкости теряет смысл для изотермических процессов, агрегатных превращений или процессов, сопровождающихся совершением какой-либо иной работы, кроме работы расширения. Обычно в процессах изобарного или изохорного нагревания используют изобарную (Ср) или изохорную (Сv) теплоемкость.

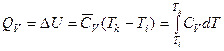


 – уравнение Майера, 1842 г.
– уравнение Майера, 1842 г.