
|
|
Способы приготовления растворов титрантов· - Стандартные (установочные) · - Стандартизованные (установленные) Приготовление стандартных растворов: 1. Готовят из точной навески исходного, химически чистого вещества, растворяя ее в воде и разбавляя полученный раствор о требуемого в мерной колбе. Требования, предъявляемые к установочным веществам: - вещество должно отвечать определенной химической формуле - химический состав вещества должен соответствовать его формуле - вещество не должно содержать примесей, не должно поглощать углекислый газ и влагу из воздуха - вещество должно хорошо растворяться в воде - растворы титрантов не должны менять свою концентрацию при хранении 2. Приготовление из фиксанала. Таким способом можно приготовить стандартные растворы из любых веществ. Фиксанал – это стеклянная, запаянная ампула, содержащая кристаллическое или жидкое вещество, изготовленное в заводских условиях. На клейме фиксанала указана точная концентрация стандартного раствора, который получится, если разбив ампулу, содержимое ее перенести количественно в мерную колбу определенного объема и довести объем полученного раствора до метки дистиллированной водой. Приготовление стандартизованных растворов: Их готовят из веществ, не соответствующих требованиям, предъявляемым установочным веществам: Не точную навеску вещества растворяют в неточном объеме воды. Точную концентрацию полученного раствора устанавливают, отбирая его аликвоту мерной пипеткой и титруя ее стандартным раствором.
Способы выражения концентрации титрантов: 1. Молярная концентрация C (B) – молярность раствора – показывает, сколько молей растворенного вещества содержится в 1 дм3 = 1л раствора.
2. Молярная концентрация эквивалентов растворенного вещества – нормальность раствора – показывает, сколько эквивалентов растворенного вещества содержится в 1 дм3=1л раствора.
Где
Mэкв – молярная масса элементов,
f - эквивалентности · f(кислоты)= f(HNO3)=1; f(H2SO4)=1/2; f(H3PO4)=1/3; · f(основания) = f(NaOH)= 1; f(Ca(OH)2)=1/2; · f(соли) = f(NaCl)=1; f(Na2O7×10H2O) = 3. Титр растворенного вещества T(B) – показывает, сколько граммов растворенного вещества содержится в 1 см3=1мл раствора.
4. Титр титранта B по определяемому веществу А T (
Где V(B) – объем раствора титранта в мл, пошедший на титрование T (
Расчет результатов объемного анализа 1. Расчет молярной концентрации эквивалентов аналита А ( Сэкв (А)) по известной молярной концентрации эквивалентов титранта Сэкв (В) и объему титранта, пошедшему на титрование V(B). Проводят по правилу пропорциональности: Сэкв (А) × V(A) = Сэкв (В) × V(B) Где V (A) - это объем раствора анализируемой пробы, взятой для проведения анализа
2. Расчет массы и массовой доли аналита А (m(A) и ω(A)) по известной молярной концентрации эквивалента титранта Сэкв(В) и объему титранта V(B), пошедшему на титрование в способах прямого и косвенного титрования. Расчет основан на законе эквивалентности: «Вещества вступаю друг с другом в химические реакции в массовых соотношениях, пропорциональных их количествам эквивалентов». Т.е. в точке эквивалентности количество эквивалентов определяемого вещества A:
Где V(B) – объем раствора титранта, дм3
Массовая доля ω(A): ω(A) = Где a – это навеска анализируемой пробы, взятой для проведения анализа 12.10.2011 Расчет массы и массовой доли аналита в способе обратного титрования по известным молярным концентрациям эквивалентов основного титранта Сэкв (В’) и вспомогательного титранта Сэкв (В”) и их объемам, израсходованным на проведение титрования V (В’) V (В”) В способе обратного титрования используют 2 титранта: основной – В’ Вспомогательный – В” Первоначально к раствору анализируемой пробы одномоментно добавляют основной титрант в заведомом избытке. Он вступает в реакцию с определяемым веществом, Непрореагировавший избыток этого титранта затем медленно оттитровывают вспомогательным титрантом В”, т.е. применительно к этому способу титрования правило эквивалентов выглядит следующим образом: в точке эквивалентности 1. 2. В методе отдельных навесов
20.10.2011 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 =
=  ,
,  (н)
(н)
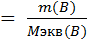
 – масса вещества, г
– масса вещества, г – количество эквивалентов вещества
– количество эквивалентов вещества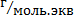


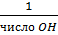
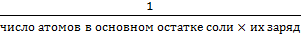
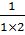

 ),
),  - это концентрация, которая используется при проведении массовых анализов одного и того же аналита А. Показывает скольким граммам определяемого вещества А в растворе соответствует добавление одного мл титранта В, т.е. массу определяемого вещества в растворе считают так:
- это концентрация, которая используется при проведении массовых анализов одного и того же аналита А. Показывает скольким граммам определяемого вещества А в растворе соответствует добавление одного мл титранта В, т.е. массу определяемого вещества в растворе считают так: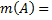 T (
T (  ) × V(B)
) × V(B)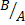 ) =
) = 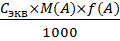
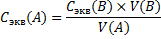

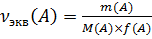 – количество эквивалентов аналита
– количество эквивалентов аналита - количество эквивалентов титранта
- количество эквивалентов титранта
 – в методе отдельных навесок
– в методе отдельных навесок – в методе пипетирования
– в методе пипетирования × 100%,
× 100%,