
|
|
Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОБЩЕЙ ХИМИИ ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ Химическая кинетика –раздел химии, задача которого – объяснение качественных и количественных изменений химических процессов, происходящих во времени. Основным понятием в химической кинетике является понятие о скорости химической реакции: Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за промежуток времени от t1 до t2, то в соответствии с определением скорость реакции равна n = -(c2-c1)/(t2-t1) = - Dc/Dt. Знак «-» в правой части уравнения обозначает следующее. По мере протекания реакции (t2-t1 > 0) концентрация реагентов убывает, следовательно, с2-с1<0, а так как скорость реакции всегда положительна, то перед дробью следует поставить знак «-». Обычно концентрации реагентов выражают в моль/л, а скорость реакции – в моль/(л.с). Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшим из них являются: концентрация. Температура и присутствие катализатора. Природа реагирующих веществ оказывает решающее влияние на скорость реакции. Так, например, водород с фтором реагирует очень энергично уже при комнатной температуре, тогда как с иодом значительно медленнее даже при нагревани и. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики – законом действующих масс. Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ. Для реакции, записанной в общем виде
в соответствии с законом действующих масс зависимость скорости от концентрации реагирующих веществ может быть представлена в виде n = k[A]nA[B]nB. [1] Здесь k – коэффициент, не зависящий от концентрации, называемый константой скорости; nA и nB – постоянные числа, называемые показателями порядка реакции по реагентам А и В. Сумма nА+nВ=n называется суммарным (общим) порядком реакции. Зависимость типа [1] строго справедлива для газов или жидких веществ (гомогенные системы) и не распространяется на реакции с участием твердых веществ (гетерогенные системы). Скорость гетерогенной реакции зависит не только от рассмотренных выше факторов, но и от величины поверхности соприкосновения между реагирующими веществами. Всякое увеличение поверхности приводит к увеличению скорости реакции. Для приближенной оценки изменения скорости широко используется температурный коэффициент скорости реакции Вант-Гоффа g. Этот коэффициент показывает, во сколько раз изменяется скорость реакции при изменении температуры на определенную величину DТ. В большинстве случаев при повышении температуры на 10 о скорость гомогенной реакции увеличивается в 2-4 раза (правило Вант-Гоффа), т.е. g=kт+10/kт. Одно из наиболее сильных средств влияния на скорость реакции - присутствие в реагирующей системе катализатора. Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается. Влияние катализаторов на скорость реакции называется катализом. Когда реагенты и катализатор находятся в одном агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагенты и катализатор находятся в различных агрегатных состояниях: обычно катализатор – в твердом, а реагирующие вещества – в жидком или газообразном ( например, в случае окисления SO2 в SO3 в присутствии оксида ванадия (V) происходит гетерогенный катализ). Механизм действия катализаторов является очень сложным. Основная гипотеза, объясняющая катализ, - предположение об образовании промежуточных продуктов при взаимодействии катализатора и реагирующего вещества. Если реакция А + В = АВ без катализатора происходит медленно, то при прибавлении катализатора К он реагирует с одним из исходных веществ, образуя непрочное и очень реакционноспособное промежуточное соединение АК (или ВК): А(В) + К = АК(ВК). Промежуточное соединение АК взаимодействует с другим исходным веществом В, образуя конечный продукт реакции АВ и выделяя катализатор в первоначальном виде: АК + В = АВ + К.
Необратимые реакции, как правило, «доходят до конца», т.е. до полного израсходования хотя бы одного из исходных веществ. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми.
H2 + I2 2HI
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево – обратной (константа скорости обратной реакции k2). В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере нарастания концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 aA + bB cC + dD + …,
aA + bB cC + dD + …,
 2KCIO3 2KCI + 3O2 .
2KCIO3 2KCI + 3O2 .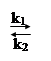 Например:
Например: