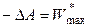|
|
Термодинамические потенциалы. Энергия Гиббса. Энергия Гельмгольца. Изменение термодинамических потенциалов как критерий равновесия и самопроизвольности процессов.Термодинамические потенциалы — внутренняя энергия, рассматриваемая как функция энтропии и обобщённых координат (объёма системы, площади поверхности раздела фаз, длины упругого стержня или пружины, поляризации диэлектрика, намагниченности магнетика, масс компонентов системы и др.), и термодинамические характеристические функции. U = U (s, x1, x2, …) Термодинамические потенциалы были введены У. Гиббсом, говорившим о «фундаментальных уравнениях»; термин термодинамический потенциал принадлежит Пьеру Дюгему. Выделяют следующие термодинамические потенциалы: 1) Внутренняя энергия; 2) Энтальпия; 3) Свободная энергия Гельмгольца; 4) Потенциал Гиббса; 5) Большой термодинамический потенциал. Термодинамические потенциалы являются функциями состояния. Поэтому приращение любого из потенциалов равно полному дифференциалу функции, которой он выражается. Полный дифференциал функции переменных определяется выражением: df = (df/dx)ydx + (df/dy)xdy Термодинамическая функция, связывающая энтальпию и энтропию системы и показывающая насколько система в данном состоянии отклонилась от равновесного состояния называется энергией Гиббса. Абсолютное значение энергии Гиббса системы определить невозможно и рассчитывают изменение энергии Гиббса /ΔG/. Отсюда следует: ΔG = ΔН – Т ·ΔS Единицей измерения энергии Гиббса является Дж/моль. Значение энергии Гиббса является критерием самопроизвольности протекания процессов: при ΔG < 0 /реально меньше –2/ процесс идет самопроизвольно; при ΔG = 0 /реально от 0 до –2/ состояние равновесия; при ΔG > 0 процесс самопроизвольно не идет. Энергией Гиббса образования вещества (по аналогии с энтальпией) называют энергию Гиббса реакции образования одного моля этого вещества из простых веществ. Энергия Гиббса образования простых веществ принимается равной нулю, если их агрегатное состояние и модификации при стандартных условиях устойчивы. Энергия Гиббса реакции в стандартных условиях может быть рассчитана по следствию закона Гесса: ΔGр = Σ (n · ΔG)прод. – Σ (n · ΔG)исх. Энергия Гельмгольца (изохорно-изотермический потенциал) является характеристической функцией, если независимыми переменными выбраны объем и температура. Полный дифференциал энергии Гельмгольца для простых систем записывается в виде:
В случае обратимых процессов как
Если V = const
Мерой убыли энергии Гельмгольца при повышении температуры вещества является энтропия. Если Т = const
Зависимость энергии Гельмгольца от температуры и объема. При протекании обратимых процессов в сложных системах, способных выполнять кроме работы расширения и другие виды работы (полезную работу):
Если процесс изотермический (Т = const)
В обратимом изотермическом процессе убыль энергии Гельмгольца равна максимальной (полной) работе, производимой системой. Если обратимый процесс протекает в изохорно-изотермических условиях, то
В обратимом изохорно-изотермическом процессе убыль энергии Гельмгольца равна максимальной полезной работе. Химические равновесия. Как равнов Кр, Кс, Кх Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем[1]. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
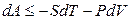
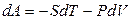
 ,
,  .
. ,
, 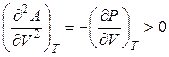

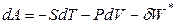
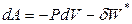 ,
,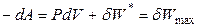 ,
, 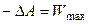
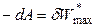 ,
,