|
|
Типы электродов. Электроды первого рода. Газовые электроды. Электроды второго рода. Электроды сравнения.В зависимости от устройства и типа электродной реакции электроды делятся на: 1. Электроды первого рода. Это электроды, обратимые относительно катиона или аниона. Они представляют собой металл или газ, находящийся в контакте с раствором, который содержит ионы этого металла или газа. Обратимость рассматривается как равновесный обмен катионом или анионом между окисленной и восстановленной формами материала электрода. Для электродного процесса Me <=> Mez+ + zē, происходящего в растворах хорошо растворимых солей металлов, потенциал электрода ϕMez+|Me=ϕ0Mez+|Me+(0,059/z)lgaMez+. Потенциал электрода первого рода, обратимого относительно катиона, становится более положительным с увеличением активности катиона в растворе. а) Газовый водородный электрод (H+|H2,Pt). Представляет собой платиновую пластинку, погруженную в раствор, содержащий ионы водорода. Ионы H+ находятся в равновесии с молекулярным водородом, который омывает пластину. При насыщении пластинки водородом устанавливается равновесие: H2 <=> 2Hадс <=> 2H++2ē Потенциал водородного электрода записывается: ϕH+|H2,Pt = ϕ0H+|H2,Pt+(Rt/zF)ln(a2H+/aH2) Активность газа зависит от концентрации адсорбированного водорода, которая определяется парциальным давлением газообразного водорода. ϕ0H+|H2,Pt=0. При давлении, равном атмосферному PH2=1,013*105Па = 1атм., z=2, aH2=PH2: ϕH+|H2,Pt = 0,059lgaH+= -0,059pH б) Газовый хлорный электрод (Cl-|Cl2,Pt). Электрод, обратимый относительно аниона. При насыщении платинированной платины хлором устанавливается равновесие: Cl2 <=> 2Clадс + 2ē <=> 2Cl-. Окисленная форма – газообразный хлор, восстановленная – анион хлора. Потенциал хлорного электрода записывается: ϕ Cl-|Cl2,Pt = ϕ0 Cl-|Cl2,Pt +(0,059/z)ln(aCl2/a2Cl-) При давлении, равном атмосферному PCl2=1,013*105Па = 1атм., z=2: ϕ Cl-|Cl2,Pt = ϕ0 Cl-|Cl2,Pt - 0,059 aCl- в) Кислородный электрод (OH-|O2,Pt): Электрод, обратимый относительно аниона. O2 <=> 2H2O + 4ē <=> 4OH-. При aO2 = pO2 = 1атм., aH2O=1, z=4: ϕOH+|O2,Pt = ϕ0OH+|H2,Pt+(Rt/zF)ln(aO2/a4OH-) = ϕ0OH+|H2,Pt – 0,059lgaOH- Потенциал электрода первого рода, обратимого относительно аниона, становится более отрицательным с ростом активности аниона. 2. Электроды второго рода. Это электроды, обратимые как по отношению к катиону Mez+, так и аниону Anz-. Они представляют собой металл, покрытый слоем трудно растворимой соли и погружённый в раствор растворимой соли данного металла с одноимённым анионом (Anz-|MeAn,Me). Электродные процессы протекают по схеме: MeAn+zē <=> Me+Anz- а) Хлорсеребряный электрод (Cl-|AgCl,Ag). Электрод состоит из серебряной проволоки, покрытой AgCl и помещённой в раствор KCl или HCl определённой концентрации. Электродный процесс заключается в переходе серебра в раствор в виде ионов Ag+, которые затем взаимодействуют с ионами хлора с образованием твердого хлорида серебра. Ag => Ag+ + ē Ag+ + Cl- <=> AgCl Потенциал электрода устанавливается в результате равновесного процесса: Cl- +Ag <=> AgCl + ē Определяется уравнением: ϕCl-|AgCl,Ag = ϕ0Ag+|Ag+ 0,059 lg (ПРAgCl/aCl-)= ϕ0Cl-|AgCl,Ag – 0,059lgaCl- ϕ0Cl-|AgCl,Ag = ϕ0Ag+|Ag+ 0,059 lg ПРAgCl- стандартный потенциал электрода. б) Каломельный электрод (Cl-|Hg2Cl2,Hg). Представляет собой ртуть, покрытую пастой из смеси каломели Hg2Cl2 со ртутью, находящуюся в контакте с раствором хлорида калия. Электродная реакция сводится к восстановлению каломели до металлической ртути и ониона хлора: Hg2Cl2+2ē <=> 2Hg + 2Cl- Электрод обратим по отношению к ионам хлора: ϕCl-|Hg2Cl2,Hg = ϕ0Cl-|Hg2Cl2,Hg – 0,059 lgaCl- Величина стандартного потенциала каломельного электрода ϕ0Cl-|Hg2Cl2,Hg зависит от концентрации хлорида калия. Например, в насыщенном раствореϕ0Cl-|Hg2Cl2,Hg= 0,244 В. Потенциал электрода второго рода становится более отрицательным с ростом активности аниона в растворе. В качестве электродов второго рода можно использовать также: SO42-|PbSO4,Pb; OH-|Cd(OH)2,Cd; OH-|HgO,Hg. Электроды второго рода широко применяются в электрохимических измерениях в качестве электродов сравнения, так как их потенциал усточив во времени и хорошо воспроизводится.
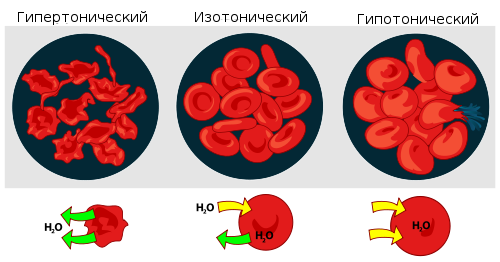
Осмос. Осмотическое девление. Изотонические, гипертонические и гипотонические растворы. Значение осмоса в биологии. Распределение вещества между двумя несмешивающимися жидкостями. Коэффициент распределения. Экстракция. Осмос– явление селективной диффузии определенного сорта частиц через полупроницаемую перегородку. Это явление впервые описал аббат Нолле в 1748 г. Перегородки, проницаемые только для воды или другого растворителя и непроницаемые для растворенных веществ, как низкомолекулярных, так и высокомолекулярных, могут быть изготовлены из полимерных пленок (коллодия) или гелеобразных осадков. Вещества диффундируют через такую перегородку, что является важным случаем осмоса, позволяющим измерять осмотическое давление. Осмотическое давление – мера стремления растворенного вещества перейти вследствие теплового движения в процессе диффузии из раствора в чистый растворитель; распределяется равномерно по всему объему растворителя, понизив первоначальную концентрацию раствора. За счет осмотического давления сила заставляет жидкость подниматься вверх, это осмотическое давление уравновешивается гидростатическим давлением. Когда скорости диффундирующих веществ станут равны, тогда осмос прекратится. Величина осмотического давления, создаваемая раствором, зависит от количества растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют). Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. π = i*C*R*T i — изотонический коэффициент раствора; Растворы с одинаковым осмотическим давлением - изотонические, в медицине - физиологическими. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Значение осмоса для растений, животных организмов и человека огромно. Благодаря осмотическому давлению наблюдается тургор клеток, т.е. клетки сохраняют упругость вследствие наличия полупроницаемой мембраны – оболочки клетки. Мембрана, окружающая эритроцит, проницаема лишь для молекул воды, кислорода, некоторых из растворенных в крови питательных веществ и продуктов клеточной жизнедеятельности; для крупных белковых молекул, находящихся в растворенном состоянии внутри клетки, она непроницаема. Поэтому белки, важные для биологических процессов, остаются внутри клетки. Осмос участвует в переносе веществ в стволах высоких деревьев, где капиллярного давления недостаточно для подъема жидкости на большие высоты. Осмос широко используется в лабораторной технике при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом «обратного» осмоса жидкостей. Осмос также играет важную роль в экологии водоемов. Если концентрация соли и других веществ в воде поднимается или падает - обитатели этих вод гибнут из-за губительного действия осмоса. Закон распределения. Если в систему, состоящую из двух несмешивающихся или ограниченно смешивающихся жидкостей, добавить третье вещество, способное растворяться в каждой из этих жидкостей, то это вещество будет распределяться между обеими жидкостями в соответствии с условием фазового равновесия. При этом каждая из обеих фаз системы будет состоять из трех компонентов. В состоянии равновесия химический потенциал растворенного вещества (компонента) одинаков в обоих растворах (фазах): μ(1)=μ(2) μ(1) и μ(2) химические потенциалы растворенного компонента соответственно в первой и второй фазах. Так как μ=μ°+ RTlna, то μ°(1)+ RTlna(1) = μ°(2)+ RTlna(1). Следовательно: RTln(a(2)/a(1)) = μ°(1) - μ°(2). Так как разность μ°(1)- μ°(2) при постоянной температуре величина постоянная, то ln(a(2)/a(1)) = (μ°(1) - μ°(2))/RT = -(∆ μ°)/RT = const Δ μ° - разность стандартных химических потенциалов растворенного вещества в первой и второй фазах. a(2)/a(1) = e^(-(∆ μ°)/RT) = K a(2)/a(1) = K К - коэффициент распределения; величина, постоянная при данной температуре. Закон распределения формулируется как: отношение активностей растворенного вещества при равновесном распределении его между двумя несмешивающимися или ограниченно смешивающимися растворителями при данной температуре есть величина постоянная при различных количествах растворенного вещества. Коэффициент распределения не зависит от активностей растворенного вещества в обоих растворителях, но зависит от температуры, природы растворенного вещества и природы растворителя. Зависимость коэффициента распределения от температуры определяется уравнением: ((∆lnK)/∆T) = ((∆H(1-2))/(RT2) Δ Н(1-2) (кДж/моль) - изменение энтальпии при переходе распределяемого вещества из одной фазы в другую. Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту. Закон распределения справедлив только в том случае, когда добавление третьего вещества в систему из двух несмешивающихся или (ограниченно смешивающихся) жидкостей не вызывает изменения растворимости этих жидкостей друг в друге. Из закона распределения вытекает, что вещество, растворённое в одном растворителе, можно извлечь из раствора, добавляя к нему второй растворитель, несмешивающийся с первым. Такое извлечение растворенного вещества из раствора называется экстракцией. Экстракция - это извлечение растворенного вещества из раствора при помощи другого растворителя (экстрагента), практически не смешивающегося с первым. Экстракция будет тем эффективнее, чем значительнее коэффициент распределения отличается от единицы в пользу второго растворителя. Например, многие органические вещества, коэффициент распределения которых между органическими растворителями и водой много больше единицы, легко и практически полностью извлекаются из водных растворов органическими растворителями, например, эфиром, бензолом, хлороформом. Извлечение выгодно вести последовательно несколькими небольшими порциями экстрагента. После первой экстракции: K = C(2)/C(1) = ((g0-g1)/g1)*(V1/V2) V1 - объем экстрагируемого раствора; g1 = g0*(V1/(V1+KV2)) После второй экстракции: K = ((g1-g2)/g2)*(V1/V2) g2 - масса вещества, оставшегося в растворе после второй экстракции. g2 = g1*(V1/(V1+KV2)) = g*(V2/(V1+KV0)2) После n экстракций: gn = g0*(Vn/(V1+KV0)n) Масса экстрагированного вещества будет равна gn = g0*(1-(V1/(V1+KV2)n) Экстракцию широко применяют в лабораторной практике и на производстве. Например, для удаления нежелательного компонента из раствора или с противоположной целью - для концентрирования ценного компонента в растворе. При состоянии равновесия распределяемое вещество обладает одинаковым химическим потенциалом в обеих фазах. Закон распределения позволяет рассчитывать эффективность различных способов экстракции. Экстракция находит широкое применение в металлургии. Например, сталь и шлак в расплавленном состоянии представляют собой пару несмешивающихся жидкостей. Очистить сталь от таких вредных примесей, как элементная сера и фосфор, можно путем наливания на поверхность расплава стали слоя жидкого шлака. Примеси распределяются между жидкими сталью и шлаком. Снижение содержания серы в стали достигают при помощи замены шлака или путём окисления серы продувкой шлака кислородом.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|