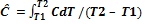|
|
Теплоёмкость. Истинная и средняя теплоемкость. Изобарная и изохорная теплоёмкости и их связь. Зависимость теплоёмкости от температуры.Теплоёмкость – это отношение количества теплоты δQ, полученной веществом при бесконечно малом изменении его состояния в каком-либо процессе, к изменению температуры dT вещества (символ С, единица Дж/К): С (T) = δQ/dT Теплоемкость единицы массы (кг, г) называется удельной (единица Дж/(кг К) и Дж/(г К)), а теплоемкость 1 моль вещества – молярной теплоемкостью (единица Дж/(моль К)). Различают истинную теплоёмкость. С = δQ/dT Среднюю теплоемкость. Ĉ = Q/(T2 – Т1) Средняя и истинная теплоемкости связаны соотношением Количество теплоты, поглощенное телом при изменении его состояния, зависит не только от начального и конечного состояния тела (в частности, от температуры), но и от условий перехода между этими состояниями. Следовательно, от условий нагревания тела зависит и его теплоемкость. В изотермическом процессе (Т = const): CT = δQT/dT = ±∞ В адиабатическом процессе (δQ = 0): CQ = δQ/dT = 0 Теплоемкость при постоянном объеме, если процесс проводят при постоянном объеме – изохорная теплоемкость СV. Теплоемкость при постоянном давлении, если процесс проводят при постоянном давлении – изобарная теплоемкость СР. При V = const (изохорный процесс): CV = δQV/dT = (ϭQ/ϭT)V = (ϭU/ϭT)V δQV = dU = CVdT При Р = const (изобарный процесс)% Cp = δQp/dT = (ϭQ/ϭT)p = (ϭH/ϭT)p Теплоемкость при постоянном давлении Ср больше, чем теплоемкость при постоянном объеме СV. При нагревании при постоянном давлении часть теплоты идет на производство работы расширения, а часть на увеличение внутренней энергии тела; при нагревании же при постоянном объеме вся теплота расходуется на увеличение внутренней энергии. Cвязь между Сp и СV для любых систем, которые могут совершать только работу расширения. Согласно первому закону термодинамики% δQ = dU +PdV Внутренняя энергия является функцией внешних параметров и температуры. dU = (ϭU/ϭT)VdT + (ϭU/ϭV)TdV δQ = (ϭU/ϭT)VdT + [(ϭU/ϭV)T + P] dV δQ/dT = (ϭU/ϭT)V + [(ϭU/ϭV)T + P] (dV/dT) Величина dV/dT (изменение объема с изменением температуры) представляет собой отношение приращений независимых переменных, то есть величина неопределенная, если не указать характер процесса, при котором происходит теплообмен. Если процесс изохорный (V = const), то dV = 0, dV/dT = 0 δQV/dT = CV = (ϭU/ϭT)V Если процесс изобарный (P = const). δQP/dT = Cp = CV + [(ϭU/ϭV)T + P] (dV/dT)P Для любых простых систем справедливо: Cp – Cv = [(ϭU/ϭV)T + P] (dV/dT)P Температура затвердевания и кипения раствора. Криоскопия и эбулиоскопия. Определение молекулярной массы растворенного вещества. Температура кристаллизации. Раствор в отличие от чистой жидкости не отвердевает целиком при постоянной температуре; при температуре, называемой температурой начала кристаллизации, начинают выделяться кристаллы растворителя и по мере кристаллизации температура раствора понижается (поэтому под температурой замерзания раствора всегда понимают именно температуру начала кристаллизации). Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания ΔТзам, равной разности между температурой замерзания чистого растворителя T°зам и температурой начала кристаллизации раствора Tзам: ΔТзам = T°зам - Tзам Кристаллы растворителя находятся в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Понижение температуры замерзания разбавленных растворов Понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора: ΔTзам = Km Это уравнение называют вторым законом Рауля. Коэффициент пропорциональности K – криоскопическая постоянная растворителя – определяется природой растворителя. Температура кипения. Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении. Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению.
Повышение температуры кипения разбавленных растворов Повышение температуры кипения растворов нелетучих веществ ΔTк = Tк – T°к пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора. Коэффициент пропорциональности E – эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества. ΔTк = Em Второй закон Рауля. Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества. Данный закон справедлив только для бесконечно разбавленных растворов. Эбулиоскопия — метод определения молекулярных масс по повышению точки кипения раствора. Температурой кипения раствора называют температуру, при которой давление пара над ним становится равным внешнему давлению. Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества. Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. В случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению:
М1 — молярная масса растворителя; ∆испН1 — энтальпия испарения растворителя; m2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя); Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества. Криоскопия – метод определения молекулярных масс по понижению температуры замерзания раствора. При охлаждении растворов наблюдается их замерзание. Температура замерзания – температура, при которой образуются первые кристаллы твердой фазы. Если эти кристаллы состоят только из молекул растворителя, то температура замерзания раствора (Т) всегда ниже температуры замерзания чистого растворителя (Тпл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора. Количественная зависимость понижения температуры замерзания от концентрации раствора выражается следующим уравнением:
М1 — молярная масса растворителя; ∆плН1 — энтальпия плавления растворителя; m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
Зависимость давления насыщенного пара растворителя от температуры. Понижение точки замерзания и повышение точки кипения растворов, их осмотическое давление не зависят от природы растворенных веществ. Такие свойства называют коллигативными. Эти свойства зависят от природы растворителя и концентрации растворенного вещества. Как правило, коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|