
|
|
Некоторые основные термодинамические понятия и определения.1. Термодинамическая система – это отдельное тело или группа тел, выделяемых (реально или мысленно) для рассмотрения из окружающей среды. Все то, что не входит в термодинамическую систему, называется окружающей средой. Система должна обязательно содержать большое число молекул, так как системы с малым числом молекул в термодинамике не рассматриваются. Изолированная система – это система, которая лишена возможности обмена и веществом, и энергией с окружающей средой. Закрытая (замкнутая) система – система, которая в ходе химического процесса обменивается с окружающей средой только энергией. Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией (например, живой организм). 2. Термодинамические свойства системы: состояние системы характеризуется совокупностью физических и химических свойств, например объем V, температура Т, энергия Q, число молей n, а также плотность, концентрация, теплоемкость и др. 3. Параметры состояния – независимые переменные, выбираемые для однозначной характеристики термодинамической системы. Например, для характеристики газа из трех параметров (давление р, объем V, температура Т) выбирают два. Интенсивные параметры состояния – не зависят от количества вещества (Т, р, концентрация и др.), при взаимодействии систем они выравниваются. Экстенсивные параметры состояния – пропорциональны количеству вещества системы (V, масса, количество электричества и др.), при взаимодействии систем они суммируются. Важнейшие параметры состояния – р, V, Т. 4. Всякое изменение параметров состояния - термодинамический процесс: а) изотермический процесс, Т = const; б) изобарный процесс, р = const; в) изохорный процесс, V = const; г) адиабатический процесс (Q=0), в котором нет обмена теплотой между системой и окружающей средой; д) изобарно-изотермический процесс, р = const, Т = const; е) изохорно-изотермический процесс, V = const, Т = const. Круговым называется процесс, в результате которого параметры состояния системы возвращаются к своим первоначальным значениям. Равновесным называется процесс, при котором система непрерывно проходит последовательный ряд равновесных состояний. Обратимым называется процесс, при котором имеется возможность возвращения системы из любого промежуточного или конечного состояния в исходное таким образом, чтобы во внешней среде не осталось никаких изменений. Все реальные процессы протекают с конечной скоростью и не являются равновесными или обратимыми. 5. Внутренняя энергия – U – характеризует общий запас энергии термодинамической системы. Включает все виды энергии движения и взаимодействия атомов, ядер, электронов, молекул. U = Eэл + Eкол + Eпост + Eвр + Eммол.вз. Изменение внутренней энергии ∆U равно разности энергий в конечном и начальном соотношениях: ∆U = U2 + U1 Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. ∆U = Q + A Соотношение, выражающее первый закон термодинамики, часто записывают в форме: Q = ΔU + A. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами. Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии. 1. В изохорном процессе (V=const). При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
U1 и U2 – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры. При изохорном нагревании тепло поглощается газом Q > 0, и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам Q < 0 2. В изобарном процессе (P=const). При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0. 3. В изотермическом процессе (T=const). При изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам. Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. 4. В адиабатном процессе (Q=0). При адиабатном процессе первый закон термодинамики выглядит:
То есть газ совершает работу за счет убыли его внутренней энергии. На плоскости (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении газ совершает положительную работу (A > 0); поэтому его внутренняя энергия уменьшается (ΔU < 0). Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом расширении.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
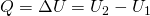
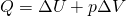
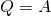
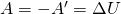
 - Изменение внутренней энергии
- Изменение внутренней энергии - Количество теплоты
- Количество теплоты - Работа внешних сил
- Работа внешних сил - Работа совершаемая системой
- Работа совершаемая системой - Объем газа
- Объем газа - Давление газа
- Давление газа