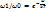|
|
Закон распределения энергии по степеням свободы.Молекулы можно рассматривать как системы материальных точек (атомов) совершающих как поступательное, так и вращательное движения. При исследовании движения тела необходимо знать его положение относительно выбранной системы координат. Для этого вводится понятие о степенях свободы тела. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела. При движении точки по прямой линии для оценки ее положения необходимо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движения по плотности, ее положения характеризуется двумя координатами;; при этом точка обладает двумя степенями свободы. Положение точки в пространстве определяется 3 координатами. Число степеней свободы обычно обозначают i. Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий). Двухатомные жесткие молекулы, например молекулы водорода, азота и др., обладают пятью степенями свободы: они имеют 3 степени свободы поступательного движения и 2 степени свободы вращательного. Согласно молекулярно-кинетической теории газов движение молекул носит беспорядочный характер; эта беспорядочность относится ко всем видам движения молекулы. При статистическом равновесии движений энергия в среднем распределяется равномерно между всеми видами движения. Закон равномерного распределения энергии по степеням свободы молекул можно сформулировать след образом: статистически в среднем на каждую степень свободы молекул приходится одинаковая энергия. Поступательное движение молекул характеризуется редней кинетической энергией, равной
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной
Закон равнораспределения, строгое доказательство которого дается в статистической термодинамике, ограничен областью применимости классического приближения. Как показывается в квантовой статистике, он справедлив для поступательного движения молекул, находящихся при температуре Т, если выполняется неравенство Флуктуации плотности. Равновесию отвечает постоянство плотности газа при заданной температуре. Однако в малых областях возможны флуктуации плотности - отклонение ее от среднего значения. Эти флуктуации определяют рассеяние света атмосферой и синий цвет неба. Вблизи критической температуры флуктуации плотности пара приводят к локальным конденсациям, что вызывает так называемую критическую опалесценцию. Таким образом, флуктуации в малых объемах могут привести к макроскопическим изменениям. Возникновение новой фазы (например, конденсация пара или кристаллизации жидкости) также связано с флуктуациями. Действительно, конденсированная фаза малого объема менее устойчива по сравнению с фазой большого объема, так как обладает дополнительной свободной поверхностной энергией. При определенных условиях ТД возможно образование фазы большого объема, но фаза малого объема может быть ТД неустойчива. Между тем фаза большого объема не может возникнуть сразу, минуя стадии малых размеров. Следовательно, как это далее будет более детально рассмотрено, зародыши новой фазы могут возникнуть лишь в результате флуктуации. Рост их приведет к ТД устойчивой фазе. Аналогичные обстоятельства имеют место при химических реакциях в конденсированных системах, так называемых топохимических реакциях. Пусть энтропия системы в равновесном состоянии равна S0 состоянии, когда система совершает флуктуацию, S1. Тогда термодинамические вероятности состояний ω0 и ω1 определяются, согласно уравнению Т. о., вероятность флуктуации определяется уменьшением энтропии, ею вызываемой. Т.к. вся система замкнута, то ΔV = 0 и ΔU = 0. Уменьшение энтропии ΔS должно вызвать увеличение энергии Гельмгольца на величину ΔA = -TΔS. =>, ω1/ω0 = eΔA/kT. Можно показать, что для системы, находящейся в термостате, действует аналогичная формула: Здесь ω работа внешнего источника, необходимая для совершения флуктуации. Формула отвечает закону распределения Больцмана, так как отдельные молекулы газа могут рассматриваться как системы, находящиеся в термостате. Флуктуация плотности делают газовую среду оптически неоднородной, как бы "мутной". Это приводит к явлению рассеяния света. Так как интенсивность рассеянного света растет с уменьшением длины волны, то синий свет рассеивается сильнее. Этим объясняется синий цвет неба.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
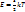

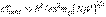 , где h,k – постоянные Планка и Больцмана, m0 – масса молекулы, N и V – число молекул и объем газа соответственно, для вращательного –
, где h,k – постоянные Планка и Больцмана, m0 – масса молекулы, N и V – число молекул и объем газа соответственно, для вращательного –  , где I – момент инерции молекулы, и, наконец, для колебательного движения –
, где I – момент инерции молекулы, и, наконец, для колебательного движения –  , где
, где  - частота нормального колебания. Значение температуры, при которой выполняются указанные неравенства, отличаются друг от друга порядком величин.
- частота нормального колебания. Значение температуры, при которой выполняются указанные неравенства, отличаются друг от друга порядком величин. , соотношением: ω1/ω0 = e(S1 - S0)/k = eΔS/k.
, соотношением: ω1/ω0 = e(S1 - S0)/k = eΔS/k.