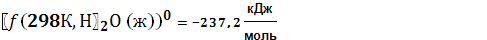|
|
Вычисление состава равновесной смесиУравнения (24) имеют огромное практическое значение, поскольку позволяет независимо от опыта, теоретически рассчитать константу равновесия наперед заданной реакции и определить равновесный, т.е. максимально возможный выход продуктов. Для вычисления Кр необходимо располагать данным и о гиббсовых энергиях образования Схему термодинамического анализа химических реакций целесообразно рассмотреть на конкретных примерах. Пример 1. Определить возможность самопроизвольной реакции
при температуре 298К и следующих составах: А: В: С: Решение. Из справочных данных находим:
∆G0 = 62,97 – 65,86 = − 2,89 кДж А.
В.
С.
Комментарий:при первых двух условиях производные отрицательные и, следовательно, реакция возможна до наступления состояния равновесия. При составе с Следует обратить внимание, что при варианте В, когда в исходном состоянии отсутствуют продукты, критерий направленности в виде производной Для реакции (32)
Кр = 3,21 Состав равновесной смеси А.
Таким образом, к моменту наступления равновесия дополнительно образовалось 0,525 моль транс-изомера. В состоянии равновесия nтранс = 1 + 0,525 = 1,525 моля; nцис = 1 – 0,525 = 0,475 моля В.
nтранс = 0,762 моля; nцис = 1 – 0,762 = 0,238 моля Степень превращения в первом случае составляет 52,5%, во втором 76,2%. Рассмотрим вариант С. Как следует из положительного значения производной
транс – изомер, Для (33) имеем ∆G0 = 65,86 – 62,97 = 2,89 кДж Этот результат очевиден. Стехиометрия обратной реакции получается при умножении стехиометрии прямого процесса на −1. Этой математической операции подвергаются и термодинамические свойства
Найдем связь между Кр обратной реакции и Кр процесса в прямом направлении
Для условия С
Проведенный расчет подтверждает ранее сделанный вывод: при условии С возможен самопроизвольный процесс, обратный реакции (32). Для реакции (33) находим
Кр = 0,31 То же самый результат получаем из уравнения ()
Для состава равновесной смеси имеем
nцис = 0,5 + 0,09 = 0,509 моля; nтранс = 2 – 0,09 = 1,91 моля; Комментарий: для реакции (33) Пример 2. Вычислить состав равновесной смеси в реакции 2NO2 (г) → N2O4 (г) (35) при следующих составах исходного состояния (в молях): А:, B:, Р = 1 атм; ∆G0(295К) = 0,52 кДж Решение: Находим константу равновесия
Кр = 0,81 А. Обозначим количество N2O4 (в молях), которое образовалось к моменту наступления равновесия через неизвестное m. Из стехиометрической реакции находим, что на образование m молей N2O4 необходимо 2m молей NO2. В состоянии равновесия
Мольные доли в состоянии равновесия
Константа равновесия имеет вид
После решения квадратного уравнения находим m = 0,014 моль.
Условие В. В состоянии равновесия
Константа равновесия в виде алгебраического уравнения имеет вид
В состоянии равновесия
Следует обратить внимание, что количество продукта в состоянии равновесия как в реакции (32), так и в реакции (35) значительно меньше, если вещество – продукт в том или ином количестве имеется в составе исходной системы: 0,525 моль по сравнению с 0,762 моль в отсутствии продукта в исходном состоянии (первая реакция) и 0,014 моль по сравнению с 0,515 моль во второй реакции. Эта закономерность справедлива в общем виде и не зависит от типа реакции: наличие в исходном состоянии продукта сдвигает равновесие в сторону реагентов. В качественной форме это положение следует из принципа Ле-Шателье, который будет рассматриваться ниже. Увеличивая количество продукта в исходном состоянии можно достичь такого положения, что
Реакция по-прежнему проходит слева направо. Если теперь количество транс-изомера в исходной смеси увеличить до 3,5 моль, то
и направление реакции сменится на противоположное. Выше отмечалось, что изменить направление реакции за счет увеличения количества продукта в исходной смеси можно лишь при относительно небольших константах равновесия. Пример 3. Вычислить константу равновесия реакции, Т = 298 К. 2SO2 (газ) + О2 (газ) → 2SO3 (газ) (36) если Решение: Стандартное изменение энергии Гиббса составляет – 140,4 кДж
Кр = 4,4·1024 Комментарий: Константа равновесия очень большая по своей величине. Реакцию можно считать, идущей в одном направлении (Кр обратной реакции 0,23·10-24) до полного превращения реагентов в продукт (ξ = 1). В состоянии равновесия присутствует только SO3, поэтому нет необходимости в решении соответствующего алгебраического уравнения. Однако опыт показывает, что, несмотря на высокое значение Кр, реакция в действительности не проявляется как процесс из-за ничтожно малой скорости реакции. Химическая термодинамика определяет лишь принципиальнцю возможность реакции и не располагает теоретическими концепциями для определения скорости процесса и времени, через которое наступает состояние равновесия. Эта задача решается в рамках раздела «Химическая кинетика и катализ», который является составной частью курса по физической химии. Реакция (36) как технологический процесс осуществляется в каталитическом режиме с применением в качестве катализатора V2O5 при температурах 670 – 720К. Из сравнения констант равновесия при температурах 298 и 950К следует, что их значение очень сильно зависит от этого параметра. При повышении температуры от 298 до 950К Кр уменьшается более чем на 24 порядка. Изменение константы равновесия с увеличением температуры можно качественно предсказать, используя принцип Ле–Шателье. Пример 4. Вычислить константу равновесия реакции при 298 К
если ∆G0(295К) = 54,69 кДж Решение:
Кр = 2,5·10-10 В настоящее время ацетальдегид производится в больших количествах для получения уксусной кислоты. Но данная реакция не может служить основой для технологического процесса из-за очень низкого значения Кр. При составе исходной смеси 6. Влияние абсолютного значения и знака ∆G0 на константу равновесия. Границы изменения Кр Уравнения 24 дают не только возможность определять константы равновесия, но и позволяют провести определенную классификацию химических реакций в зависимости от их термодинамических параметров. В связи с этим целесообразно рассмотреть границы изменения Кр, используя для этих целей реакцию с наиболее простой стехиометрией А → В (37) При условии, что в исходном состоянии
Если при некоторых начальных условиях реакция (37) в прямом направлении в принципе невозможна, то само состояние равновесия для такой реакции не имеет физико-химического смысла, поскольку m = 0. Иными словами варианту термодинамической невозможности реакции соответствует значение Кр → 0
Пример такого варианта рассматривался ранее при определении возможности превращения цис-изомера бутена-2 в транс-изомер при составе исходной смеси, обозначенной «С». Далее пусть исходное вещество А полностью превращается в продукт В. В этом случае m = 1, конечное состояние имеет значение ξ = 1и
Это означает, что полное стехиометрическое превращение реагентов в продукты возможно при Кр → ∞. С практической точки зрения такими характеристиками обладают реакции с очень большими значениями Кр. Таким образом, границы изменения Кр описываются соотношением
При рассмотрении особенностей химических реакций в зависимости от их термодинамических свойств целесообразно исходить из граничного условия ∆G0 = 0; Кр = 1 В этом случае независимо от типа стехиометрического уравнения продукты и реагенты находятся в состоянии равновесия в сопоставимых количествах. Так в реакции А → 2В, Кр = 1
Количество продукта В в состоянии равновесия 0,894 моля; реагента – 0,106 моля. Для реакции 2А → В, Кр = 1
имеет место противоположный результат nB = 0,55 моль; nА = 2 – 2·0,55 = 0,90 моль Если ∆G0 небольшая отрицательная или положительная величина: ∆G0 < 0, Кр > 1; ∆G0 > 0, Кр < 1 константа равновесия соответственно существенно больше или меньше единицы. В состоянии равновесия также присутствуют продукты и реагенты, но различие в их количествах более значительное. В зависимости от состава исходной смеси и температуры реакция возможна как в прямом так и в обратном направлениях. Большая отрицательная величина стандартной энергии Гиббса, ∆G0 << 0 приводит к тому, что для константы равновесия имеет место соотношение Кр >>1. Для такого рода реакций характерны очень высокие константы равновесия. Так для реакции Н2 (Г) + ½ О2 (Г) → Н2О (Ж) стандартная энергия Гиббса, она же энергия образования жидкой воды
и
Кр = 4,2·1041 Подобного рода реакции по существу односторонние, они проходят до полного превращения реагентов в соответствующие продукты. Заметим, что ∆G0 = ∆H0 – T∆S0. Поэтому отрицательное значение ∆G0 обеспечивается экзотермичностью реакции, ∆H0 < 0 и положительным значением ∆S0. Для реакции ∆G0 << 0 главную роль играет энтальпийный фактор ∆Н0 << 0, т.е. высокая экзотермичность процесса. Так для реакции образования жидкой воды ∆Н0 (295К) = – 285,8 кДж/моль. Энтальпийный фактор T∆S0 независимо от знака S0 (∆S0 < 0; ∆S0 > 0) в этом случае не играет существенной роли. Наконец, если ∆G0 >> 0, Кр << 1, константа равновесия при таких термодинамических параметрах очень мала. Пример такой реакции рассматривался выше. Из термодинамических данных можно сделать вывод, что при невысоких температурах реакция с такими термодинамическими свойствами практически невозможна. Однако термодинамические свойства процесса могут кардинально изменится при высоких температурах, если ∆S0 > 0. Интересным примером такого рода является реакция
При 298К ∆G0 = 101,64 кДж и
Кр = 1,90·10-18 Реакция при таких термодинамических параметрах с практической точки зрения невозможна. Можно также отметить, что большое положительное значение ∆G0 обусловлено эндотермичностью процесса ∆H0 = 137,00 кДж. При 900К реакция по-прежнему эндотермична, ∆G0 = 22,38 кДж. Но из-за благоприятного энтропийного фактора реакция становится практически возможной. При 900К ∆S0 = 135,19 Дж/моль·К и ∆G0 = 22380 – 135,19·900 = –99,29 кДж
Кр (900К) = 5,90·105 Реакция при этой температуре проходит с приемлемыми скоростями и является важным процессом для промышленного получения этилена.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 соединений, которые участвуют в данной реакции, или иметь данные для вычисления ∆Н0 и ∆S0 этой реакции. По известной Кр можно далее определить состав равновесной смеси и, следовательно, теоретический выход продуктов реакции. Для определения состава равновесной смеси необходима величина (её называют неизвестной), которая связывала бы количество молей веществ в состоянии равновесия с их количеством в исходном состоянии. Такая связь ведет к преобразованию константы равновесия в явное алгебраическое уравнение некоторой степени относительно этой величины. Решая это уравнение, находят значение указанной величины в состоянии равновесия и состав равновесной смеси. В принципе для этих целей можно использовать ξе, но в практических расчетах по константам равновесия она почти не применяется. Для преобразования константы равновесия в алгебраическое уравнение часто используют количество молей m какого-то продукта, например, С, которое образовалось к моменту наступления состояния равновесия. Пример ее использования рассматривался выше.
соединений, которые участвуют в данной реакции, или иметь данные для вычисления ∆Н0 и ∆S0 этой реакции. По известной Кр можно далее определить состав равновесной смеси и, следовательно, теоретический выход продуктов реакции. Для определения состава равновесной смеси необходима величина (её называют неизвестной), которая связывала бы количество молей веществ в состоянии равновесия с их количеством в исходном состоянии. Такая связь ведет к преобразованию константы равновесия в явное алгебраическое уравнение некоторой степени относительно этой величины. Решая это уравнение, находят значение указанной величины в состоянии равновесия и состав равновесной смеси. В принципе для этих целей можно использовать ξе, но в практических расчетах по константам равновесия она почти не применяется. Для преобразования константы равновесия в алгебраическое уравнение часто используют количество молей m какого-то продукта, например, С, которое образовалось к моменту наступления состояния равновесия. Пример ее использования рассматривался выше. цис – бутен –2 транс – бутен –2
цис – бутен –2 транс – бутен –2 = 1;
= 1;  = 1
= 1 = 62,97 кДж/моль;
= 62,97 кДж/моль;


 , реакция в прямом направлении невозможна, возможна обратная реакция и также до состояния равновесия.
, реакция в прямом направлении невозможна, возможна обратная реакция и также до состояния равновесия. стремится к – ∞. Этот результат имеет общее значение: при условии, когда в исходной смеси отсутствуют продукты, любая реакция в принципе самопроизвольна. Поэтому при рассмотрении общей проблемы о направленности и выявлений критерия о возможности реакции в виде неравенства (17) исходная смесь содержит как реагенты, так и продукты. Из общего соотношения (17) следует частный вариант
стремится к – ∞. Этот результат имеет общее значение: при условии, когда в исходной смеси отсутствуют продукты, любая реакция в принципе самопроизвольна. Поэтому при рассмотрении общей проблемы о направленности и выявлений критерия о возможности реакции в виде неравенства (17) исходная смесь содержит как реагенты, так и продукты. Из общего соотношения (17) следует частный вариант  когда
когда  , что означает, что хА и хВ в исходном состоянии также равны нулю.
, что означает, что хА и хВ в исходном состоянии также равны нулю.

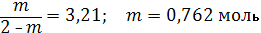
 при исходном составе С реакция цис-изомер → транс-изомер невозможна, но возможна реакция в противоположном направлении
при исходном составе С реакция цис-изомер → транс-изомер невозможна, но возможна реакция в противоположном направлении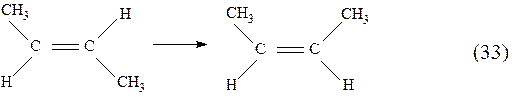
 цис – изомер,
цис – изомер,
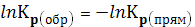




 поэтому в соотвествии с уравнением 24а
поэтому в соотвествии с уравнением 24а  и Кр< 0 (
и Кр< 0 (  и Кр = 1). Кр реакции (33) почти в 10 раз меньше Кр реакции цис-изомер → транс-изомер, для которой
и Кр = 1). Кр реакции (33) почти в 10 раз меньше Кр реакции цис-изомер → транс-изомер, для которой  . Из-за невысокого значения Кр из двух молей транс-изомера образуется 0,09 моля цис-изомера как продукта. Степень превращения реагентов составляет всего 0,09/2 · 100% = 4,5%. При высоком значении Кр, Кр>> 1, если
. Из-за невысокого значения Кр из двух молей транс-изомера образуется 0,09 моля цис-изомера как продукта. Степень превращения реагентов составляет всего 0,09/2 · 100% = 4,5%. При высоком значении Кр, Кр>> 1, если  , состояние равновесия наступает в окрестностях ξ = 1. В этом случае реакция в противоположном направлении практически невозможна (
, состояние равновесия наступает в окрестностях ξ = 1. В этом случае реакция в противоположном направлении практически невозможна (  , Кр<< 1) при любом физически реальном составе исходной смеси. В этом смысле ее невозможно обратить. Реакция с Кр>> 1 односторонняя и проходит до полного превращения реагентов в продукты (еще один комментарий ниже).
, Кр<< 1) при любом физически реальном составе исходной смеси. В этом смысле ее невозможно обратить. Реакция с Кр>> 1 односторонняя и проходит до полного превращения реагентов в продукты (еще один комментарий ниже).


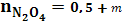 ;
; 

 ;
; 

 ;
; 
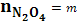 ;
; 

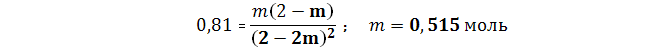
 ;
; 
 станет положительной величиной, при этом направление процесса сменится на противоположное. В качестве примера найдем условия, при которых реакция изомеризации цис-бутена-2 в транс-изомер будет проходить в обратном направлении. В отсутствии продукта в исходном состоянии при количество транс-изомера в состоянии равновесия равно 0,763 моля. Если теперь в качестве исходной смеси взять смесь, состоящую из 0,8 моля транс-изомера и 1,00 моля цис-изомера
станет положительной величиной, при этом направление процесса сменится на противоположное. В качестве примера найдем условия, при которых реакция изомеризации цис-бутена-2 в транс-изомер будет проходить в обратном направлении. В отсутствии продукта в исходном состоянии при количество транс-изомера в состоянии равновесия равно 0,763 моля. Если теперь в качестве исходной смеси взять смесь, состоящую из 0,8 моля транс-изомера и 1,00 моля цис-изомера
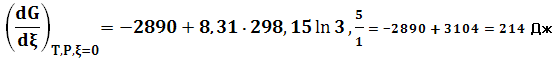

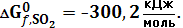

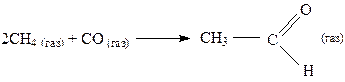

 = 1моль;
= 1моль;  1моль количество ацетальдегида в состоянии равновесия составляет не более 10-18 моля.
1моль количество ацетальдегида в состоянии равновесия составляет не более 10-18 моля. = 1моль;
= 1моль;  0 моль
0 моль


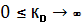
 0 моль
0 моль