
|
|
Уравнение Аррениуса. Энергия активации. Теория активных соударений.12 Для определения скорости и направления реакции основным фактором является энергия активации. Скорость любой химической реакции зависит от числа столкновений реагирующих молекул в единицу времени, но если бы все столкновения сопровождались взаимодействием, то реакции протекали бы в очень короткие отрезки времени. Число эффективных столкновений, по сравнению с числом реальных столкновений, как правило, очень мало, что может быть отражено в уравнении. В 1889 г. С. Аррениус выдвинул теорию активации, объясняющую сущность химических реакций. Согласно этой теории при столкновениях во взаимодействие вступают только те молекулы, которые обладают определенным запасом энергии, необходимой для осуществления той или иной реакции. Эти молекулы называются активными молекулами. По-видимому, скорость химической реакции зависит от концентрации активных молекул. Это нашло свое отражение в исследованиях С. Аррениуса, который показал, что количество активных молекул может быть вычислено по уравнению При постоянной температуре число активных молекул в среднем сохраняется постоянным. Минимальный запас энергии, которым должны обладать молекулы для вступления в ту или иную реакцию, можно рассматривать как своеобразный энергетический барьер этой реакции. Энергия, которая должна быть сообщена неактивным молекулам для перехода их в активное состояние, называется энервией активации. Эту энергию обычно выражают в ккал/мольГ 19.Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими. Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород. Ионы
20.Ферменты — биологические катализаторы. Они катализируют тысячи химических реакций, из которых слагается метаболизм микроорганизма. В настоящее время известно около двух тысяч ферментов. Оксидоредуктазы — это ферменты, катализирующие окислительно-восстановительные реакции. Они играют большую роль в процессах биологического получения энергии. К ним относятся дегидрогеназы (НАД, НАДФ, ФАД), цитохромы (Ь, с, сь а, а), ферменты, участвующие в переносе водорода, электронов и кислорода, и др.
21. Фермент как биологические катализаторы. Ферментативный катализ. Уравнение Михаэлисса – Ментен и его анализ. Ферменты являются катализаторами химических реакций, происходящих в организме. В настоящее время известно около 10 000 Г биохимических реакций, каждая из которых катализируется ферментами. Характерными особенностями ферментов являются чрезвычайно высокая эффективность. Эффективность ферментов объясняется, во-первых, концентрационным фактором - т.е. активной сорбцией ферментом субстрата, что эквивалентно увеличению его концентрации. Концентрационный фактор увеличивает скорость в тысячи раз. Во-вторых, ферменты проявляют ориентационный эффект, который увеличивает скорость реакции еще примерно в тысячу раз. Сущность ориентационного эффекта состоит в наличии стереоспецифического контакта активного центра фермента с субстратом. В-третьих, ферменты обладают полифункциональным эффектом, который имеет решающее значение. Этот эффект состоит в одновременном действии на молекулу субстрата нескольких атакующих групп фермента или в ряде последовательных воздействий на превращающуюся связь. Ферменты - это белки или их производные, которые благодаря особой трехмерной структуре выступают в качестве высокоспецифичных биохимических катализаторов. В целом клетка нуждается в разнообразных ферментах, каждый из которых катализирует строго определенную реакцию. Активный центр, т. е. та часть фермента, которая участвует в непосредственном взаимодействии с субстратом, включает лишь несколько аминокислотных остатков, причем эти остатки могут принадлежать участкам белковой цепи, взаимно удаленным друг от друга. Активный центр создается определенной конфигурацией белковой молекулы, образующей щель, в которую встраивается активируемый субстрат. Это объясняет специфичность ферментов. Характерной чертой ферментативного катализа является то, что скорость ферментативной реакции увеличивается до определенной постоянной величины. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
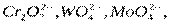 катализирующие разложение пероксида водорода, образуют с ним промежуточные соединения, которые далее распадаются с выделением кислорода.
катализирующие разложение пероксида водорода, образуют с ним промежуточные соединения, которые далее распадаются с выделением кислорода.