|
|
Биосинтез тимидиловых нуклеотидовТимидин-5'-монофосфат (дТМФ) образуется из дУМФ в реакции, катализируемой тимиди-латсинтазой (рис. 10-18). Донором метильной группы, появляющейся в 5-положении пиримидинового кольца в молекуле дТМФ, служит кофермент тимидилатсинтазы - N5,N10-метилен-Н4-фолат. С помощью этого кофермента в молекулу дУМФ включается метиленовая группа и восстанавливается в метальную, используя 2 атома водорода от Н4-фолата.
Рис. 10-17. Восстановление рибонуклеозиддифосфатов в 2'-дезоксирибонуклеозиддифосфаты. 1 - рибонуклеотидредуктаза (РНР); 2 - тиоредоксинредуктаза. Образование субстрата тимидилатсинтазной реакции - дУМФ осуществляется двумя путями (рис. 10-19):
Скорость синтеза дТМФ зависит также от количества второго субстрата тимидилатсинтазной реакции - N5,N10-метилен-Н4-фолата, пополнение запасов которого осуществляется при участии 2 ферментов: дигидрофолатредуктазы, которая с участием NADPH восстанавливает Н2-фолат в Н4-фолат, и серии гидроксиметилтрансферазы, осуществляющей перенос β-гидроксиметиленовой группы серина на Н4-фолат (см. раздел 9). У человека дТМФ образуется, главным образом, из дЦДФ. "Запасные" пути синтеза дезоксирибонуклеотидов В быстроделящихся клетках наряду с синтезом дезоксинуклеотидов с помощью рибонуклеотид-редуктазного комплекса и тимидилатсинтазы активируются реакции, обеспечивающие повторное использование тимина и дезоксицитидина в реакциях, катализируемых ферментами "запасных" путей и обратимых реакций катаболизма. Под влиянием тимидинфосфорилазы протекает следующая реакция: Тимин + Дезоксирибоза-1-фосфат → Тимидин + Н3Р04.
Рис. 10-18. Синтез дТМФ из дУМФ.
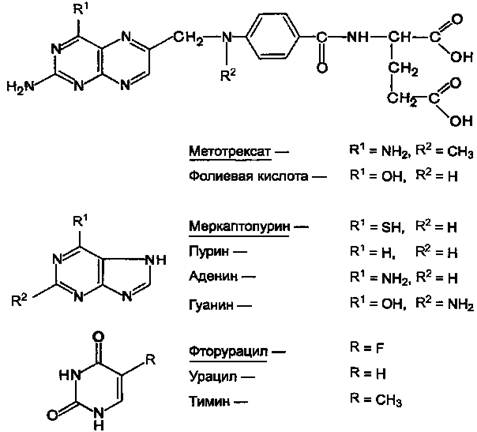
Рис. 10-19. Образование ТТФ из дЦДФ и дУДФ. 1 - дЦМФ дезаминаза; 2 -тимидилатсинтаза; 3 - дНМФ- и дНДФ 4 - дигидрофолатредуктаза; 5 - серингидроксиметилтрансфераза. Тимидинкиназа катализирует следующую реакцию: Тимидин + АТФ → дТМФ + АДФ. Дезоксицитидинкиназа катализирует следующую реакцию: Дезоксицитидин + АТФ → дЦМФ + АДФ. 54. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.(тут я мало что нашел…) Препараты этой группы являются антагонистами естественных метаболитов. При наличии опухолевых заболеваний используют в основном следующие вещества (см. структуры). Антагонисты фолиевой кислоты: Метотрексат (аметоптерин). Антагонисты пурина: Меркаптопурин (леупурин, пуринетол). Антагонисты пиримидина: Фторурацил (флуороурацил); Фторафур (тегафур); Цитарабин (цитозар).
Рисунок 11.Химические структуры ряда метаболитов и их антиметаболитов. Химически антиметаболиты лишь похожи на естественные метаболиты, но не идентичны им. В связи с этим они вызывают нарушение синтеза нуклеиновых кислот. Это отрицательно сказывается на процессе деления опухолевых клеток и приводит их к гибели. Действуют антиметаболиты на разных этапах синтеза нуклеиновых кислот, ингибируя ферменты их синтеза. Так, механизм антибластомного эффекта метотрексата, очевидно, заключается в том, что он угнетает дигидрофолатредуктазу, а также тимидил-синтетазу. Это нарушает образование пуринов и тимидина, в результате чего угнетается синтез ДНК. Меркаптопурин, по-видимому, препятствует включению пуринов в полинуклеотиды. Полагают, что фторурацил нарушает синтез нуклеотидов или тимидина и их включение в ДНК. Имеются данные о том, что в клетках опухоли фторурацил превращается в 5-фтор-2-дезокси-уридин-5-монофосфат, который является ингибитором фермента тимидил-синтетазы. Нарушения обмена нуклеотидов: оротацидурия, ксантинурия. (ксантинурия маловато) Оротацидурия Это единственное нарушение синтеза пиримидинов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовои кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата. Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления клеток эритроцитарного ряда. Её диагностируют у детей на том основании, что она не поддаётся лечению препаратами фолиевой кислоты. Недостаточность синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям. Гиперэкскреция оротовои кислоты сопровождается нарушениями со стороны мочевыводя-щей системы и образованием камней. При отсутствии лечения больные обычно погибают в первые годы жизни. При этом оротовая кислота не оказывает токсического эффекта. Многочисленные нарушения в работе разных систем организма вызваны "пиримидиновым голодом". Для лечения этой болезни применяют уридин (от 0,5 до 1 г/сут), который по "запасному" пути превращается в УМФ. Уридин + АТФ → УМФ + АДФ. Нагрузка уридином устраняет "пиримидиновый голод", а поскольку из УМФ могут синтезироваться все остальные нуклеотиды пиримидинового ряда, то снижается выделение оротовои кислоты из-за восстановления механизма ретроингибирования КАД-фермента. Для больных оротацидурией лечение уридином продолжается в течение всей жизни, и этот нуклеозид становится для них незаменимым пищевым фактором. Кроме генетически обусловленных причин, оротацидурия может наблюдаться:
Ксантинурия – наследственная энзимопатия, связанная с дефектом ксантиноксидазы, что приводит к нарушению катаболизма пуринов до мочевой кислоты. В плазме крови и моче может наблюдаться 10-ти кратное снижение уровня мочевой кислоты, но увеличивается в 10 и более раз экскреция ксантина и гипоксантина. Основное клиническое проявление – образование ксантиновых конкрементов, величиной до нескольких миллиметров, коричневого цвета, сравнительно мягкой консистенции. Постепенно может развиться патология почек. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|