|
|
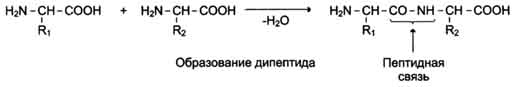
Классификация аминокислот, их строение и номенклатура. Образование пептидной связи.Осмос, осмотическое давление. Биологическое значение осмоса. Понятие об изотонических, гипертонических и гипотонических растворах. Осмос – диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора с разной концентрацией. Полупроницаемая мембрана — перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Выравнивание концентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному. Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничность. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим. Осмос играет важную роль. · Мембрана, расположенная вокруг нормальной клетки крови пропускает только нужные ей вещества, а крупные молекулы белка не могут проникнуть в клетку. · Осмос участвует в переносе питательных веществ в стволах высоких деревьев. · Используется при определении малярных характеристик полимера. · Для получения некоторых полимеров. · Играет большую роль в экологии водоемов.
Буферные растворы и буферная емкость. Буферные системы живого организма и их значение.
Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (например, СН3СООН и CH3COONa) или слабого основания и его соли (например, NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Буферная ёмкость—Количество мл щелочи или кислоты, которое необходимо добавить к раствору чтобы сместить его ph на 1. Буферные растворы имеют большое значение для протекания процессов в живых организмах. Известно большое число буферных растворов (бикарбонатный, фосфатные NaHCO3=Na(+) + HCO3(-) HCO3=H(+) + HCO3 (-), Белковые, ацетатные. Классификация аминокислот, их строение и номенклатура. Образование пептидной связи.
Аминокислоты – Производные карбоновых кислот, в которых Н заменен на аминокислоту. Общая структурная формула аминокислот: Аминокислоты в живых организмах встречаются в свободном виде и выполняют самостоятельные функции, а так же в связанном виде (ковалентные связи), пептиды, белки. В организме встречаются модифицированные аминокислоты: (Написать формулу цистина) Классификация аминокислот: Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты подразделяются: 1. по заряду и по содержанию SH группы, карбоксильных и аминогрупп. a. Моноамино монокарбоновые b. Моноамино дикарбоновые c. Диамино монокарбоновые 2. Заменимые и незаменимые 3. В зависимости от наличия циклического кольца
Получение: 1.Галогенопроизводные карбоновых кислот + NH3 = NH3 + CH3-CHCl-COOH = (-HCl) CH3-CHNH2-COOH 2. Гидролиз белков, пептидов 3. Ферментативный метод 4. Присоединение NH3 к непредельным карбоновым кислотам (бета-кислота) NH3+CH3-CH = CH-C=OOH à CH3-CHNH2-CH2-C=OOH
Свойства: Температура кипение 250 градусов, Растворимы в воде, Сладковатый вкус, Амфотерны (ионосодержащие).
Изомерия: 1. NH2-CH2-COOH пространственный изомер (глицин исключение)
Изоэлектрическая точка – когда молекулы выпадают в осадок меняя ph, так как у молекулы равный заряд (+,-).
Химические свойства: 1. Дезаминирование
Внутримолекулярное (с образованием 2-ой связи) 2. Декарбоксилирование NH2-CH2-C=OOH à (-COO) NH2-CH3 3. Метилирование Написать формулу. 4. Образование пептидной связи:
Пептиды образуются в результате взаимодействия аминокислот и называются олигопептиды (число аминов до 10) и полипептиды (число аминов до 100). При синтезе пептидов возникает необходимость защиты от вступления в характерную реакцию или аминогруппу или карбоксильную группу. Реакция этерификации: Вписать формулу. NH2CHR-COOH = (спирт R-OH) NH2-CHR-C=OOR

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (верхнюю альфа не надо)
(верхнюю альфа не надо)