
|
|
Вычисление скорости, константы и температуры коэффициента скорости реакцииЗадача №1. Взаимодействие Решение. 1. Увеличение давления вдвое равноценно двойному увеличению концентрации (с) Ответ.Скорость реакции увеличится в 8 раз. Задача №2. Считается, что концентрация хлора (зеленоватый газ с резким запахом) в воздухе выше 25 ppm опасна для жизни и здоровья, но, имеются данные, что если пациент восстановился после острого тяжелого отравления этим газом, то остаточных явлений не наблюдается. Определите, как изменится скорость реакции: Решение. 1. Если обозначить концентрации 2. После увеличения концентраций в 3-и раза они будут равны 3. Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому 4. Увеличение скорости реакции по отношению к первоначальной определяется отношением соответственно: 1) Ответ. Скорость реакции увеличится в: 1) , 2) Задача № 3. Как изменяется скорость взаимодействия исходных веществ при изменении температуры с Решение. 1. Температурный коэффициент 2. Если же изменение температуры: 3. По таблице антилогарифмов находим: Ответ. При изменении температуры (т.е. при повышении) скорость увеличится в 67,7 раз. Задача № 4. Вычислите температурный коэффициент Решение. 1. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа:
Ответ. Задача № 5. Для одной из реакций были определены две константы скорости: при Решение. 1. По двум значениям констант скорости реакции, используя уравнение Аррениуса, определяем величину энергии активации реакции: 2. Рассчитаем константу скорости реакции при Ответ. Вычисление константы химического равновесия и определение направление смещения равновесия по принципу Ле-Шателье. Задача №6.Двуокись углерода / Решение. 1. Парциальное давление газа равно общему давлению, умноженному на объемную долю газа в смеси, поэтому: а) б) в) 2. Подставляя эти значения в выражение константы равновесия, получим:
3. Взаимосвязь между Ответ. Задача № 7.В каком направлении сместится равновесие в следующих реакциях: 1. 2. 3. а) при повышении температуры, б) при понижении давления, в) при увеличении концентрации водорода? Решение. 1.Химическое равновесие в системе устанавливается при постоянстве внешних параметров ( 2. Рассмотрим влияние на вышеуказанные реакции всех 3-х факторов, влияющих на химическое равновесие. а) При повышении температуры равновесие смещается в сторону эндотермической реакции, т.е. реакции, идущей с поглощением тепла. 1-я и 3-я реакции – экзотермические / б) При понижении давления равновесие смещается в сторону возрастания числа молей газов, т.е. в сторону большего давления. В 1-ой и 3-ей реакциях в левой и правой частях уравнения будет одинаковое число молей газов (2-2 и 1-1 соответственно). Поэтому изменение давления не вызовет смещения равновесия в системе. Во 2-ой реакции в левой части 4 моля газов, в правой – 2 моля, поэтому при понижении давления равновесие сместится в сторону обратной реакции. в) При увеличении концентрации компонентов реакции равновесие смещается в сторону их расхода. В 1-ой реакции водород находится в продуктах, и увеличение его концентрации усилит обратную реакцию, в ходе которой он расходуется. Во 2-ой и 3-ей реакциях водород входит в число исходных веществ, поэтому увеличение его концентрации смещает равновесие в сторону реакции, идущей с расходом водорода. Ответ. а) При повышении температуры в реакциях 1 и 3 равновесие будет смещено влево, а в реакции 2 – вправо. б) На реакции 1 и 3 понижение давления не повлияет, а в реакции 2 – равновесие будет смещено влево. в) Повышение температуры в реакциях 2 и 3 повлечет за собой смещение равновесия вправо, а в реакции 1 – влево. 1.2. Ситуационные задачи №№ с 8 по 21для закрепления материала (выполнить в протокольной тетради). Задача № 8.Как изменится скорость окисления глюкозы в организме при снижении температуры с Задача № 9.Используя приближенное правило Вант-Гоффа, вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз? Температурный коэффициент скорости принять равным 3. Задача № 10.Для практической остановки реакции применяют быстрое охлаждение реакционной смеси («замораживание реакции»). Определите, во сколько раз изменится скорость реакции при охлаждении реакционной смеси с 40 до Задача № 11.Изотоп Задача № 12.Гидролиз некоторого синтетического гормона (фармпрепарата) является реакцией первого порядка с константой скорости 0,25 Задача №13.Период полураспада радиоактивного Задача № 14.Период полураспада инсектицида (ядохимиката, применяемого для борьбы с насекомыми) составляет 6 месяцев. Некоторое количество его попало в водоем, где установилась концентрация Задача №15. Жиры и углеводы окисляются с заметной скоростью при температуре 450 — 500°, а в живых организмах — при температуре 36 — 40°. В чем причина резкого уменьшения температуры, необходимой для окисления? Задача № 16.Пероксид водорода разлагается в водных растворах на кислород и воду. Реакцию ускоряют как неорганический катализатор (ион Задача № 17Константа скорости распада пенициллина при Задача №16.Раствор лекарственного вещества содержит 1500 активных единиц в 1 мл. Через 20 дней концентрация активных единиц снижается до 120 единиц в мл. Рассчитайте константу скорости и период полупревращения, если реакция протекает по первому порядку. Задача №18.Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К. Задача № 19.Какими способами в системе Задача №20.При состоянии равновесия системы Задача № 21.Метанол является сильным нервно - сосудистым ядом, обладающим выраженными кумулятивными свойствами и при поступлении в желудочно-кишечный тракт быстро всасывается и через 1 ч. начинает циркулировать в крови, где может быть обнаружен в течение 3-4 дней. Вычислите константу равновесия реакции образования метилового спирта: 1.3. Контрольные вопросы 1. Объясните, что означают термины: скорость реакции, константа скорости? 2. Как выражается средняя и истинная скорость химических реакций? 3. Почему о скорости химических реакций имеет смысл говорить только для данного момента времени? 4. Сформулируйте определение обратимой и необратимой реакции. 5. Дайте определение закона действующих масс. В равенствах, выражающих этот закон, отражена ли зависимость скорости реакции от природы реагирующих веществ? 6. Как зависит скорость реакции от температуры? Что называется энергией активации? Что такое активные молекулы? 7. От каких факторов зависит скорость гомогенной и гетерогенной реакции? Приведите примеры. 8. Что такое порядок и молекулярность химических реакций? В каких случаях они не совпадают? 9. Какие вещества называются катализаторами? Каков механизм ускоряющего действия катализатора? 10. В чем заключается понятие «отравление катализатора»? Какие вещества называют ингибиторами? 11. Что называется химическим равновесием? Почему оно называется динамическим? Какие концентрации реагирующих веществ называют равновесными? 12. Что называют константой химического равновесия? Зависит ли она от природы реагирующих веществ, их концентрации, температуры, давления? Каковы особенности математической записи для константы равновесия в гетерогенных системах? 13. Что такое фармакокинетика лекарств? 14. Процессы, происходящие с лекарственным препаратом в организме, количественно характеризуются рядом фармакокинетических праметров. Приведите основные из них. Экспериментальная часть Лабораторная работа. Зависимость скорости химической реакции от концентрации Принцип метода. Метод основан на определении времени Процесс разложения многостадийный:
Скорость второй реакции наименьшая, является предметом изучения, поэтому она и определяет скорость разложения В зависимости от значения порядка реакции
Цель работы.Установить зависимость скорости реакции разложения динатрия тиосульфата / Приборы и оборудование: секундомер, бюретки вместимостью 25 мл, стаканы вместимостью 50 мл, мензурки. Реактивы: серная кислота и динатрий тиосульфата с концентрацией 0,15 моль/л; вода дистиллированная. Ход работы: 1. В 4 колбы из бюреток (* лучше пипеткой) налейте объемы 0,15 М раствора 2. В первый стакан прилейте 15 мл 0,15 М раствора H2SO4, одновременно включите секундомер. Определите время от момента добавления кислоты до появления в растворе слабой опалесценции. Опыт повторите 2 раза. 3. Проведите аналогичные опыты с 2, 3 и 4- ми стаканами. 4. Данные и результаты эксперимента внесите в таблицу №2.1. Таблица 2.1 Зависимость скорости разложения
5. Обработка результатов.Выполните следующие нижеуказанные расчеты: а) Для всех проведенных опытов (т.е. 1, 2, 3 и 4-й), пользуясь полученными данными, определите молярную концентрацию тиосерной кислоты 1) б) Вычислите для всех проведенных опытов (т.е. 1, 2, 3 и 4-й) 1) в) Рассчитайте скорость химической реакции для всех проведенных опытов (т.е. 1, 2, 3 и 4-й) по формуле: 1) 6. Выводы. 1)Постройте график зависимости скорости 3. Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний). Образец теста 1. «При увеличении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза» – это формулировка _____. 1) закона действующих масс 2) закон Генри 3) правила Вант-Гоффа 4) закона Гесса 2. Отношение произведения равновесных активностей продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению активностей исходных веществ при данной температуре есть величина постоянная, называемая _____. 1) константой химического равновесия 2) степенью диссоциации 3) свободной энергией Гиббса 4) константой скорости реакции 3. Если температурный коэффициент скорости равен 3, то при увеличении температуры от 1) увеличится в 27 раз 2) уменьшится в 27 раз 3) увеличится в 81 раз 4)уменьшится в 81 раз 4. Количественное влияние температуры на скорость химической реакции выражается уравнением _____. 1) Вант-Гоффа 2) Аррениуса 3) Фарадея 4) Рауля 5. Реакция окисления этанола в организме человека идет по уравнению: 1) уменьшится в 25 раз 2) увеличится в 25 раз 3) уменьшится в 5 раз 4) увеличится в 5 раз 6. В организме человека тростниковый сахар (сахароза) под влиянием ферментов превращается в глюкозу и фруктозу. Если увеличить температуру на 1) уменьшится в 3 раз 2) увеличится в 9 раз 3) уменьшится в 9 раз 4) увеличится в 27 раз 7. Величина 1) концентрации реагирующих веществ 2) катализатора 3) давления 4) природы реагирующих веществ и температуры 8. Реакция окисления глюкозы в организме человека протекает по уравнению: 1) 2) 3) 4) 9. В растениях в процессе фотосинтеза с участием природного катализатора пигмента (хлорофилла) за счет солнечной энергии образуется глюкоза по схеме: 1) 2) 3) 4) 10. Порядок реакции для указанной реакции: 1) 0 2) 1 3) 2 4) 3 11. При повышении давления в 4 раза скорость химической реакции: 1) 64 2) 124 3) 924 4) 1024 12. Бикарбонат натрия, применяющийся в медицине при отравлении циклическими антидепрессантами, подвергается гидролизу по реакции: 1) 2) 3) 4) 13. Температурный оптимум действия ферментов в живом организме в градусах составляет_____ 1) 35-40 2) 65-70 3) 15-20 4) 0-10 4. Вопросы по теме для самостоятельного изучения их студентами. 1. Современные проблемы химической кинетики и фармакокинетики. 5. Практические навыки, которыми должен овладеть студент по теме занятия. Студент должен владеть навыками: - вычисления различных кинетических расчетов, а также константы химического равновесия для прогнозирования и интерпретации физико-химических процессов, в том числе умения использовать эти знания применительно к конкретным системам, встречающиеся в биологических объектах для управления биохимическими процессами, а также для моделирования ряда реакций, протекающих с участием ферментов ž уменияработать с учебной, научной и справочной литературой, а также с сетью Интернет для постоянного усовершенствования своих знаний, с целью анализировать сложившуюся ситуацию и принимать решения в пределах своей профессиональной компетенции и полномочий.
Приложения А Приложение1 Термодинамические свойства некоторых неорганических соединений при 298 К
Продолжение приложение1 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 со свободным кислородом приводит к образованию высокотоксичного диоксида азота /
со свободным кислородом приводит к образованию высокотоксичного диоксида азота /  /, хотя эта реакция в физиологических условиях протекает медленно и при низких концентрациях
/, хотя эта реакция в физиологических условиях протекает медленно и при низких концентрациях 
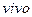 не играет существенной роли в токсическом повреждении клеток, но, однако патогенные эффекты резко возрастают при его гиперпродукции. Определите, во сколько раз возрастает скорость взаимодействия оксида азота (II) c кислородом при увеличении давления в смеси исходных газов в два раза, если скорость реакции
не играет существенной роли в токсическом повреждении клеток, но, однако патогенные эффекты резко возрастают при его гиперпродукции. Определите, во сколько раз возрастает скорость взаимодействия оксида азота (II) c кислородом при увеличении давления в смеси исходных газов в два раза, если скорость реакции  описывается уравнением
описывается уравнением 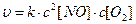 ?
? . Поэтому скорости взаимодействия, соответствующие
. Поэтому скорости взаимодействия, соответствующие  и
и  ,примут в соответствии с законом действия масс выражения:
,примут в соответствии с законом действия масс выражения:  и
и 
 , протекающей в газовой фазе, если увеличить в 3-и раза: концентрацию
, протекающей в газовой фазе, если увеличить в 3-и раза: концентрацию 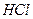 , 3) давление /
, 3) давление /  /?
/? и
и  , то выражение для скорости реакции примет вид:
, то выражение для скорости реакции примет вид:  .
. для
для  для
для  2)
2) 
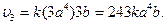
 , 2)
, 2)  , 3)
, 3)  .
. , 3)
, 3)  раза.
раза. до
до 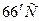 , если температурный коэффициент реакции равен 2,5?
, если температурный коэффициент реакции равен 2,5? показывает, как меняется скорость реакции при изменении температуры на каждые
показывает, как меняется скорость реакции при изменении температуры на каждые  (правило Вант-Гоффа):
(правило Вант-Гоффа):  .
. , то с учетом того, что
, то с учетом того, что 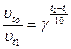 , получаем:
, получаем:  . Отсюда,
. Отсюда,  .
. .
. скорость возрастает в 128 раз.
скорость возрастает в 128 раз. .Решая уравнение относительно
.Решая уравнение относительно  ,
,  . Следовательно,
. Следовательно,  0,00670 и при
0,00670 и при  0,06857. Определите константу скорости этой же реакции при
0,06857. Определите константу скорости этой же реакции при  .
. . Для данного случая:
. Для данного случая: 
 Отсюда:
Отсюда:  Дж/моль.
Дж/моль. , используя в расчетах константу скорости при
, используя в расчетах константу скорости при  и уравнение Аррениуса:
и уравнение Аррениуса:  . Для данного случая:
. Для данного случая: 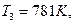
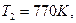 и с учетом того, что:
и с учетом того, что:  , получаем:
, получаем:  . Следовательно,
. Следовательно, 
 / в отличие от моноксида углерода /
/ в отличие от моноксида углерода /  / не нарушает физиологических функций и анатомической целостности живого организма и удушающий эффект их обусловлен лишь присутствием в высокой концентрации и снижением процентного содержания кислорода во вдыхаемом воздухе. Чему равна константа равновесия реакции /
/ не нарушает физиологических функций и анатомической целостности живого организма и удушающий эффект их обусловлен лишь присутствием в высокой концентрации и снижением процентного содержания кислорода во вдыхаемом воздухе. Чему равна константа равновесия реакции /  /:
/: 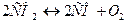 при температуре
при температуре  , выраженная через: а) парциальные давления реагирующих веществ
, выраженная через: а) парциальные давления реагирующих веществ  , зная, что состав равновесной смеси выражается объемными долями:
, зная, что состав равновесной смеси выражается объемными долями: 


 , а общее давление в системе составляет
, а общее давление в системе составляет  Па?
Па? Па;
Па; Па;
Па; Па;
Па; Па.
Па. , где
, где  – разность между числом молей газообразных продуктов реакции и газообразных исходных веществ. Для данной реакции:
– разность между числом молей газообразных продуктов реакции и газообразных исходных веществ. Для данной реакции:  . Тогда:
. Тогда: 
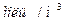 .
. Па.
Па. 

 ;
;
 ;
;
 и др.). Если эти параметры меняются, то система выходит из состояния равновесия и начинает преобладать прямая (вправо) или обратная реакции (влево). Влияние различных факторов на смещение равновесия отражено в принципе Ле Шателье.
и др.). Если эти параметры меняются, то система выходит из состояния равновесия и начинает преобладать прямая (вправо) или обратная реакции (влево). Влияние различных факторов на смещение равновесия отражено в принципе Ле Шателье.  до
до  , если температурный коэффициент скорости реакции равен 4 ?
, если температурный коэффициент скорости реакции равен 4 ? , если температурный коэффициент реакции равен 2,7.
, если температурный коэффициент реакции равен 2,7.
 , применяющийся для лечения некоторых опухолей, имеет период полураспада 8,1 суток. Через какое время содержание радиоактивного йода в организме пациента уменьшится в 5 раз?
, применяющийся для лечения некоторых опухолей, имеет период полураспада 8,1 суток. Через какое время содержание радиоактивного йода в организме пациента уменьшится в 5 раз? (
(  ). Как изменится концентрация этого гормона через 2 месяца?
). Как изменится концентрация этого гормона через 2 месяца? равен 5600 лет. В живом организме за счет обмена веществ поддерживается постоянное количество
равен 5600 лет. В живом организме за счет обмена веществ поддерживается постоянное количество  от исходного. Определите, когда жил мамонт?
от исходного. Определите, когда жил мамонт?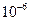 моль/л. За какое время концентрация инсектицида понизится до уровня
моль/л. За какое время концентрация инсектицида понизится до уровня 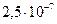 моль/л?
моль/л? ), так и биоорганический (фермент каталаза). Энергия активации реакции в отсутствие катализатора 75,4 кДж/моль. Ион
), так и биоорганический (фермент каталаза). Энергия активации реакции в отсутствие катализатора 75,4 кДж/моль. Ион  равна
равна 
 , а при
, а при 
 можно смещать равновесие в сторону большого выхода
можно смещать равновесие в сторону большого выхода  при заданной концентрации
при заданной концентрации  ?
? концентрация азота 0,3 моль/л; водорода 0,9 моль/л; аммиака 0,4 моль/л. Вычислите константу равновесия реакции и исходные концентрации азота и водорода.
концентрация азота 0,3 моль/л; водорода 0,9 моль/л; аммиака 0,4 моль/л. Вычислите константу равновесия реакции и исходные концентрации азота и водорода. при стандартных условиях, если
при стандартных условиях, если  и
и  кДж/моль;
кДж/моль;  ,
,  и
и 
 Дж/моль.
Дж/моль. образования опалесценции, обусловленной образованием серы /
образования опалесценции, обусловленной образованием серы / 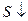 / в ходе разложения динатрий тиосульфата серной кислотой. Время
/ в ходе разложения динатрий тиосульфата серной кислотой. Время 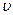 . Это дает возможность судить об относительной скорости реакции: чем больше скорость, тем меньше время.
. Это дает возможность судить об относительной скорости реакции: чем больше скорость, тем меньше время. (1)
(1) (2)
(2) (3)
(3) . Образующаяся в результате окислительно-восстановительного процесса сера вызывает помутнение раствора. Однако помутнение становится заметным после того, как концентрация серы достигнет определенной величины. Следовательно, чем выше концентрация веществ в смеси, тем быстрее между ними идет реакция. Другими словами, скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в степенях, равных стехиометрическим коэффициентам – закон действующих масс.
. Образующаяся в результате окислительно-восстановительного процесса сера вызывает помутнение раствора. Однако помутнение становится заметным после того, как концентрация серы достигнет определенной величины. Следовательно, чем выше концентрация веществ в смеси, тем быстрее между ними идет реакция. Другими словами, скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в степенях, равных стехиометрическим коэффициентам – закон действующих масс. можно выделить 4-е основные зависимости скорости реакции от концентрации, графики которых показаны на рисунке 2.1.
можно выделить 4-е основные зависимости скорости реакции от концентрации, графики которых показаны на рисунке 2.1.
 /
/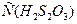
 ,
моль/л
,
моль/л


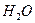




 по формуле:
по формуле: . 2) и т.д.
. 2) и т.д.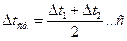 . 2) и т.д.
. 2) и т.д.
 (ось абсцисс) реагирующих веществ. Согласно закону действия масс зависимость скорости реакции от концентрации должна выражаться прямой линией, проходящей через начало координат. 2) Сделайте вывод о зависимости скорости реакции от концентрации и определите порядок реакции.
(ось абсцисс) реагирующих веществ. Согласно закону действия масс зависимость скорости реакции от концентрации должна выражаться прямой линией, проходящей через начало координат. 2) Сделайте вывод о зависимости скорости реакции от концентрации и определите порядок реакции. до
до  скорость химической реакции _____ раз .
скорость химической реакции _____ раз . . При повышении концентрации исходных веществ в 5 раз скорость данной реакции _____раз.
. При повышении концентрации исходных веществ в 5 раз скорость данной реакции _____раз. при
при  . Кинетическое уравнение скорости этой реакции имеет вид: _____.
. Кинетическое уравнение скорости этой реакции имеет вид: _____.



 , Кинетическое уравнение скорости этой реакции имеет вид: _____.
, Кинетическое уравнение скорости этой реакции имеет вид: _____.



 имеет вид: _____.
имеет вид: _____. увеличивается в _____ раз (а).
увеличивается в _____ раз (а). . Уравнение константы равновесия этой реакции имеет вид: _____.
. Уравнение константы равновесия этой реакции имеет вид: _____.



 .
.

 .
.



 (водн)
(водн)
 (т)
(т)
 (т)
(т)
 (т)
(т)
 (т)
(т)

 (водн)
(водн)
 корунд
корунд
 (т)
(т)

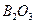 (т)
(т)
 (t)
(t)

 (волн)
(волн)
 (т)
(т)
 (т)
(т)
 (т)
(т)
 (т)
(т)

 (ж)
(ж)
 (г)
(г)
 (г)
(г)
 (г)
(г)
 (водн)
(водн)
 (водн)
(водн)
 (водн)
(водн)

 (водн)
(водн)
 (т)
(т)
 (т)
(т)
 (т)
(т)