
|
|
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХАЛабораторная работа № 140 Cр/СV
Цель работы: Наблюдение газовых процессов в условиях лабораторного эксперимента. Определить экспериментальным путем величину показателя адиабаты
Приборы и принадлежности: 1)Лабораторная установка «Определение показателя адиабаты» со встроенным манометром; 2) секундомер или часы.
Теплоёмкостью СТ тела называется физическая величина, численно равная количеству тепла, которое надо передать телу, чтобы повысить его температуру на один градус.
Единицы СИ теплоёмкости Удельной теплоёмкостью вещества называется теплоёмкость единицы массы этого вещества.
Единицы СИ удельной теплоёмкости Молярной теплоёмкостью вещества называется теплоёмкость одного моля этого вещества.
Используя первое начало термодинамики, выразим молярную теплоёмкость через изменение внутренней энергии и работу расширения газа:
Важной особенностью газов является то, что теплоёмкость газа для разных процессов различается. Так для изохорического процесса где i – число степеней свободы молекул данного газа; R – универсальная газовая постоянная. Отношение теплоёмкостей (молярных или удельных) газа при постоянном давлении и при постоянном объёме
Адиабатическим процессом называется процесс, проистекающий без теплообмена с окружающей средой, то есть газ не отдаёт и не получает тепла извне. Входящая в уравнение (5) константа Одним из самых простых методов определения величины γ является метод, предложенный в 1819 г. Клеманом и Дезормом. Этот метод и положен в основу данной работы. Суть метода заключается в следующем. Берётся некоторая масса газа в состоянии 1 с параметрами состояния p1, Т1 и адиабатически расширяется до атмосферного давления p2 с понижением температуры до Т2 (состояние 2). Уравнение (5) с учётом уравнения состояния идеального газа преобразуется к виду:
Затем газ изохорически нагревается до исходной температуры Т1. При этом давление возрастает до величины р3 (состояние 3). Процесс выравнивания температуры подчиняется закону Гей-Люссака:
Исключая с помощью (7) отношение температур
Разрешая это уравнение относительно γ, находим:
В нашем случае давления р1 и р3 мало отличаются от атмосферного давления р2 и выражение (9) можно существенно упростить. Введем обозначение:
С учетом этого выражение (9) преобразуется к виду:
В выражении (6)
Как следует из (11) для определения γ необходимо измерить избыточное (над атмосферным) давление в сосуде до адиабатического расширения и его избыточное давление после изохорного нагревания. Для этой цели используется U-образный жидкостной манометр, у которого разность уровней жидкости в сообщающихся трубках пропорциональна разности между измеряемыми давлениями и атмосферным. Отметим, что процессы, происходящие в ёмкости, не являются равновесными и их нельзя отобразить графически. Приведённые графики являются некоторым приближение к реальным процессам, происходящим в реальном эксперименте. Следует особо подчеркнуть, что обе величины должны измеряться в состоянии термодинамического равновесия, то есть после прекращения теплообмена. На практике метод Клемана и Дезорма реализуется следующим образам (рис.1). В жёсткую ёмкость 1 накачивается воздух насосом 2 при открытом кране 3 до давления р1 , превышающее атмосферное на 2000-2500 Па (200-250 мм. вод. столба), после чего кран 3 закрывают. После установления термодинамического равновесия воздуха в ёмкости с окружающей средой (состояние 1 на рис.2) открывают клапан 4, соединяющий баллон с атмосферой. Излишек воздуха выходит из ёмкости, давление в ёмкости уменьшается до атмосферного, температура понижается (состояние 2 на рис. 2). Если процесс протекает достаточно быстро (за время 0,1- 0,5с), то теплообменом ёмкости с атмосферой можно пренебречь, то есть считать процесс расширения воздуха адиабатическим. Затем клапан 4 закрывают и выжидают некоторое время (около 3 минут), пока оставшийся в ёмкости воздух не нагреется до комнатной температуры (состояние 3 на рис. 2).
Применяемая методика требует соблюдения следующих условий. - в ходе процесса 1-2 выпускной клапан баллона должен быть перекрыт в момент, когда давление в ёмкости станет равным атмосферному; - время τ, в течение которого давление в ёмкости уменьшается от р1 до р2 должно быть достаточно мало, чтобы пренебречь теплообменом воздуха находящегося в ёмкости с окружающей средой. На практике эти условия трудновыполнимы. Во-первых, из-за инертности измерительной системы (жидкостного манометра), во-вторых, сам процесс выравнивания давления в ёмкости занимает значительное время. И физически трудно определить момент закрытия клапана в конце неравновесного процесса выравнивания давления в ёмкости с атмосферой. Значение ∆Н в формуле (11) соответствует условию, что клапан сброса закрыли в момент окончания адиабатного процесса. Если закрыть клапан раньше или позже, то результат вычисления по формуле (11) даст или завышенное или заниженное значение.. Поэтому для получения значений Предположим, что после достижения давления р2 клапан сброса остаётся открытым ещё некоторое время τ. За это время происходит изобарический нагрев воздуха (процесс 2-2' на рис. 2) за счёт теплообмена со стенками ёмкости, а также продолжающее истечение газа через открытый клапан за счёт теплового расширения. После закрытия клапана (состояния 2', 2′′ и т.д.) происходит изохорический нагрев (процессы 2'-3', 2′′-3′′ и т.д.). Давление в ёмкости достигает значений р3', р3" и т.д.. Конечные состояния (точки 3', 3′′) находятся на изотерме 1-3-3'-3". При этом Δр3> Δр3'>Δр3". Этим величинам соответствует разность уровней Очевидно, что величина
Строгое доказательство этого утверждения можно найти в Приложении к данной работе. Следовательно, если повторить такой опыт несколько раз с разными значениями τ, то путём экстраполяции полученного графика прямолинейной зависимости (12) в область, где величина τ = 0, можно найти 2. Описание экспериментальной установки.
В стеклянный баллон 1 (рис. 4 - 5), соединенный с компрессором 2, через напускной кран 3 накачивается воздух. Клапан сброса воздуха 4 , находящийся на верхней крышке установки позволяет резко уменьшить давление в баллоне практически без теплообмена с окружающей средой.
На рис.4 представлена передняя панель установки 6, на которой размещаются тумблер «СЕТЬ» 7, тумблер «КОМПРЕССОР» 8, водяной U- образный манометр 5, кран 3 перепуска воздуха со следующими положениями: ОТКРЫТ - положение ручки крана на данной отметке открывает линию к компрессору 2. ЗАКРЫТ - положение ручки крана на данной отметке перекрывает баллон 1. РЕГУЛИРОВКА УРОВНЯ- положение ручки крана на данной отметке позволяет отрегулировать уровень воды в коленах U- манометра после заполнения баллона воздухом. Измеряемые величины: ΔH и Δh - разница высот столбов жидкости в манометре после накачивания воздуха в баллон и выравнивания температур и после выпуска воздуха и выравнивания температур. Разность давлений после накачивания воздуха в баллон регистрируется также датчиком, соединённым параллельно с U- манометром. Показания датчика выводятся на прибор ТРМ 200 и могут быть внесены в компьютер через преобразователь интерфейса АС-4 для последующей обработки. Установка работает следующим образом. В баллон компрессором 2 накачивается воздух до определенного избыточного давления ( разность уровней в коленах U- манометра должна составлять 20 – 25 см.). В каждой серии опытов эта разность должна быть одинаковой (регулируется краном 3). После выравнивания температур воздуха в баллоне и окружающей среды (когда давление перестает изменяться) проводится измерение высоты столбов жидкости в правом Н1 и левом Н2 коленах манометра. Затем осуществляется сброс давления через выпускное отверстие с клапаном 4. При этом клапан удерживается в открытом состоянии определённое время ( от 5 до 25с). После того, как клапан сброса закрылся, осуществляется изохорный процесс теплообмена с окружающей средой. Температура воздуха в баллоне приближается к температуре окружающей среды. После того, как прекратится изменение давления в баллоне, проводится измерение высоты столбов жидкости h1 и h2 в U-манометре и, соответственно, их разность Δh.
3. Порядок выполнения работы.
1.Включить установку тумблером «СЕТЬ». Повернуть ручку крана 3 в положение ОТКРЫТ(положение 9 на рис. 4 и 5). Включить тумблером 8 «КОМПРЕССОР». Накачать воздух в баллон до установления разности уровней воды в манометре 200-250 мм. Поле этого закрыть напускной клапан поворотом ручки крана 3 в положение ЗАКРЫТ (положение 10 на рис. 4 и 5). 2.Произвести дополнительную регулировку разности уровней в манометре, стремясь к тому, чтобы в каждом опыте эта разность была одинаковой. Для этого ручка крана 3 плавно переводится в положение РЕГУЛИРОВКА УРОВНЯ(положение 11) и обратно 3.Подождать 2-4 минуты до тех пор, пока температура воздуха в баллоне сравняется с температурой окружающей среды и, соответственно, положение уровней в манометре перестанет изменяться. 4.По нижнему уровню мениска в коленах манометра определить уровни H1 и H2 Записать эти значения, а также их разность 5.Резко (но не сильно!!) нажать выпускной клапан 4 и после выравнивания уровней в манометре закрыть его (отпустить). 6.Через 3-4 минуты, после того как уровни воды в манометре стабилизируются, определить значения уровней h1 и h2 и занести результаты в табл. 1. 7.Повторить опыт (пункты 1-6) не менее 5 раз и записать результаты в табл. 1. 8.Провести измерения (пункты 1-6), последовательно увеличивая время τ, в течение которого клапан остаётся открытым (5, 10, 15, 20, 25 с.). Результаты занести в табл. 2.
Таблица 1.
Таблица 2.
4. Обработка и представление результатов На основе полученных результатов измерений провести дальнейшую обработку и результаты занести в соответствующие таблицы: 1. По данным табл. 1 вычислить значения коэффициента Пуассона γ по формуле (11). 2. Вычислить среднее значение 3. По данным табл. 2 вычислить значения 4. Рассчитать значение 5. По формуле (11) вычислить значение γ. 6. Сравнить полученные в пп. 2 и 5 значения со значением коэффициента Пуассона для идеального двухатомного газа (число степеней свободы двухатомной молекулы i = 5) по формуле
5. Контрольные вопросы. 1.Дайте определение адиабатического процесса. 2. Какие термодинамические процессы происходят в ёмкости с воздухом при проведении опыта? 3. Вывести соотношение для экспериментального определения коэффициента Пуассона 4.Какие величины измеряются в опыте? 5.Какие факторы влияют на корректность экспериментального определения коэффициента Пуассона? 6.Как исключить факторы, влияющие на точность определения показателя Пуассона? 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
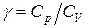 для воздуха и сравнить с теоретическим значением.
для воздуха и сравнить с теоретическим значением.

 ,
,
 .
.
 .
. ,
,
 - число молей, содержащихся в m кг вещества;
- число молей, содержащихся в m кг вещества;  молярная масса вещества.
молярная масса вещества. ,
,
 , а для изобарического процесса
, а для изобарического процесса 
 ,
,
 называется коэффициентом Пуассона.
называется коэффициентом Пуассона.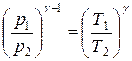 ,
,
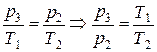 ,
,
 из (6), получаем
из (6), получаем ,
,
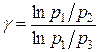 ,
,
 ,
, 
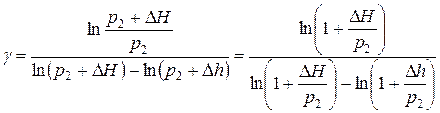 ,
,
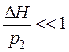
 . В курсе высшей математики показано, что с достаточной точностью выполняется соотношение
. В курсе высшей математики показано, что с достаточной точностью выполняется соотношение  , если
, если  . Следовательно, формула (6) может быть представлена в упрощенном виде:
. Следовательно, формула (6) может быть представлена в упрощенном виде: ,
,


 жидкостного манометра.
жидкостного манометра.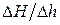 представляет собой некоторую степенную функцию времени τ. Следовательно, логарифм этого отношения является линейной функцией времени τ вида:
представляет собой некоторую степенную функцию времени τ. Следовательно, логарифм этого отношения является линейной функцией времени τ вида:
 , соответствующее переходу из состояния 2 в состояние 3 (рис. 2) и исключить таким образом влияние притока тепла во время адиабатного расширения воздуха в ёмкости
, соответствующее переходу из состояния 2 в состояние 3 (рис. 2) и исключить таким образом влияние притока тепла во время адиабатного расширения воздуха в ёмкости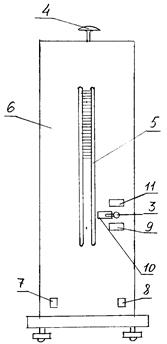

 в табл. 1. (Разность давлений можно также определить по прибору ТРМ200 в кПа).
в табл. 1. (Разность давлений можно также определить по прибору ТРМ200 в кПа).
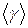
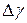
 , с
, с



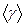 и абсолютную погрешность
и абсолютную погрешность 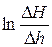 и построить график зависимости
и построить график зависимости  . Через нанесенные на график точки провести прямую, наиболее близкую к ним. Продлить полученную прямую до пересечения с осью ординат и определить значение функции
. Через нанесенные на график точки провести прямую, наиболее близкую к ним. Продлить полученную прямую до пересечения с осью ординат и определить значение функции  при
при  .
. .
.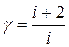 и сделать выводы.
и сделать выводы.