
|
|
Влияние концентрации реагирующих веществ на состояниеХимическое равновесие»
Минск 2012 Цель работы: изучить влияние различных факторов на скорость и равновесие физико-химических процессов. Экспериментальная часть 1. Зависимость скорости реакции от концентрации реагирующих веществ Ход и данные опыта Для наблюдения зависимости скорости реакции от концентрации реагирующих веществ используем реакцию взаимодействия раствора иодата калия KIO3 (раствор А) с раствором сульфита натрия Na2SO3 (раствор Б) в присутствии серной кислоты и крахмала (индикатора на свободный йод):
или в ионной форме
Реакция проводится при постоянной температуре (комнатной), постоянной концентрации иодата калия и переменной концентрации сульфита натрия. Приготовим раствор Б различных концентраций в соответствии с табл.1. Поместим в одну пробирку 20 капель раствора А, в другую-20 капель раствора Б. Сольем содержимое пробирок и отметим время появления признака реакции (синей окраски).Затем в аналогичном порядке выполним остальные варианты опытов и данные внесем в табл. 1. Вычислим относительную скорость реакции (1/t, с-1) и занесем в табл. 1.
Расчеты и анализ результатов опыта 1. Начертим график зависимости скорости реакции от концентрации реагирующих веществ, откладывая по оси абсцисс относительную концентрацию раствора сульфита натрия, по оси ординат – относительную скорость реакции.
Рисунок 1. ____________________________________________________
2. Объясните, почему при повышении концентрации сульфита натрия изменяется (увеличивается или уменьшается) скорость исследуемой реакции? С чем это связано? _____________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Какой кинетический закон устанавливает зависимость скорости реакции от концентрации реагирующих веществ? Запишите его выражение для исследуемой реакции. Подтверждает ли полученный в опыте результат выполнение этого закона для исследуемой реакции?_______________________ _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 1.3. Вывод (о влиянии концентрации веществ на скорость реакции). ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Зависимость скорости реакции от температуры Ход и данные опыта Для изучения зависимости скорости реакции от температуры использовали реакцию окисления щавелевой кислоты (H2C2O4) перманганатом калия (KMnO4) в присутствии серной кислоты. Уравнение реакции имеет вид
или в ионной форме
Реакция проводилась при постоянной концентрации реагирующих веществ и переменной температуре (табл. 2.). Поместим в 4 пробирки по 20 капель раствора щавелевой кислоты, в другие 4 пробирки поместим по 20 капель KMnO4 и 20 капель концентрированной H2SO4. Нагреем содержимое пробирок до температур, указанных в табл.2, сольем их и отметим время обесцвечивания растворов. Запишем в таблицу данные опыта. Относительную скорость реакции определим как 1/τ и результаты внесем в табл. 2.
Расчеты и анализ результатов опыта 1. Запишем правило Вант-Гоффа. ________________________________ Рассчитаем температурный коэффициент в интервалах: 30 – 40 °С ( ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Построим график зависимости скорости реакции от температуры, отложив по оси абсцисс температуру, по оси ординат – относительную скорость.
Рисунок 2. ___________________________________________________ __________________________________________________________________
Какой вид имеет полученная зависимость?________________________ 3. Объясните, почему при увеличении температуры увеличивается скорость исследуемой реакции. Как это связано с изменением числа активных частиц ?___________________________________________________________ ____________________________________________________________________________________________________________________________________Запишите уравнение Аррениуса_______________________________________ __________________________________________________________________ 2.3. Вывод (о влиянии температуры на скорость реакции).____________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ Ход и данные опыта В две пробирки поместим одинаковое количество мела и мрамора. Добавим одинаковые объемы 10 % раствора соляной кислоты. Наблюдаем выделение газа в обеих пробирках. Отметим, что в пробирке _______________________ выделение газа закончится раньше, чем в пробирке __________________________. Реакция проводилась при постоянной концентрации всех реагирующих веществ.
Анализ результатов опыта 1. Запишем в молекулярном и ионном виде уравнения реакций взаимодействия мела и мрамора с соляной кислотой, учитывая, что мел и мрамор имеют одинаковую химическую формулу CaCO3.________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________ 2. Объясним различие скоростей реакций. В данном случае на увеличение скорости реакции оказывает влияние_______________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Запишем выражение закона действия масс для каждой реакции.____________ ____________________________________________________________________________________________________________________________________________________________________________________________________ 3.3. Вывод (о влиянии величины поверхности реагирующих веществ на скорость гетерогенной реакции).______________________________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Влияние концентрации реагирующих веществ на состояние Равновесия Ход и данные опыта Влияние концентрации реагирующих веществ на химическое равновесие исследовали при постоянной температуре на примере реакции взаимодействия хлорного железа (FeCl3) с роданидом калия (KCNS): FeCl3 + 3KCNS Û Fe(CNS)3 + 3KCl. Красное окрашивание роданида железа Fe(CNS)3 позволяет следить за сдвигом химического равновесия при изменении концентрации реагирующих веществ. Изменение интенсивности окраски полученных растворов по сравнению с цветом раствора в контрольной пробирке указывает на направление смещения химического равновесия при изменении состава равновесной системы посредством добавления определенного реагента: FeCl3, KCNS или KCl. Результаты наблюдений представлены в табл. 3.
Анализ результатов опыта 1. Запишем кинетическое условие равновесия исследуемой реакции. __________________________________________________________________ 2. Запишем ЗДМ для прямой и обратной реакций и объясним, как изменится скорость, и какой реакции (прямой или обратной) при каждом указанном (табл. 3) изменении концентрации веществ. К чему это приводит? В каком направлении смещается равновесие в каждом случае? __________________________________________________________________ __________________________________________________________________ При увеличении концентрации _____________________________равновесие_сместится____________________________________________________________________________________ При увеличении концентрации _____________________________равновесие_сместится____________________________________________________________________________________ 3. Подтверждает ли установленное в ходе опыта изменение скоростей реакций и смещение равновесия принцип Ле Шателье?_______________________ ____________________________________________________________________________________________________________________________________ 4. Запишем выражение константы равновесия (КС) для данной равновесной системы. Зависит ли численное значение константы равновесия от концентрации реагирующих веществ?_______________________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________ 4.3. Вывод(о влиянии концентрации веществ на состояние равновесия) __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ 5. Влияние температуры на состояние равновесия Ход и данные опыта Реакцию взаимодействия иода с крахмалом можно представить в виде иод + крахмал Û иодокрахмал В результате данной реакции образуется вещество сложного состава – иодокрахмал, синего цвета. Изменение интенсивности синего окрашивания иодокрахмала позволяет следить за сдвигом химического равновесия при изменении температуры. При нагревании данной равновесной системы наблюдаем––––––––––––– _________________________________, при охлаждении – _______________ Анализ результатов опыта 1. Почему при повышении температуры в большей степени (результат опыта) увеличивается скорость обратной реакции? Объясните, как это связано с энергией активации и тепловым эффектом реакции. В каком направлении смещается равновесие? ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Подтверждает ли установленное в ходе опыта изменение скоростей реакций и смещение равновесия принцип Ле Шателье?___________________ ____________________________________________________________________________________________________________________________________ 3. Как и почему изменится численное значение константы равновесия данной реакции при повышении температуры? _________________________ ____________________________________________________________________________________________________________________________________ 5.3. Вывод (о влиянии температуры на положение химического равновесия обратимой реакции). __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Ответы на контрольные вопросы 1. Запишите выражение ЗДМ для реакций: а) 2S(к) + 2H2O(г) → O2(г) + 2H2S(г); б) 2NOCl(г) → 2NO(г) + Сl2(г). Как изменится их скорость, если: для реакции «а» увеличить объем в 2 раза, для реакции «б» повысить температуру на 20К ( ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Для реакции ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Константа равновесия реакции СО(г) + Н2О(г) _______________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 .
.
 .
. ),
),  (
(  ),
),  (
(  ), вычислим его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант‑Гоффа? От каких факторов зависит численное значение γ ?
), вычислим его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант‑Гоффа? От каких факторов зависит численное значение γ ?

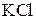
 .
. )? Ответ подтвердите расчетами.
)? Ответ подтвердите расчетами. константа скорости при 288 К равна 0,475·10-3 л /( моль ∙мин), а при 298 К – 0,203 ·10-2 л /( моль∙мин). Вычислите энергию активации этой реакции и проверьте для данного примера на основании соответствующих расчетов применимость правила Вант-Гоффа.
константа скорости при 288 К равна 0,475·10-3 л /( моль ∙мин), а при 298 К – 0,203 ·10-2 л /( моль∙мин). Вычислите энергию активации этой реакции и проверьте для данного примера на основании соответствующих расчетов применимость правила Вант-Гоффа. СО2(г) + Н2(г) при температуре 927 °С равна 0,74. Рассчитайте значение
СО2(г) + Н2(г) при температуре 927 °С равна 0,74. Рассчитайте значение  этой реакции при 727 °С, если равновесные концентрации веществ равны (моль/л): 0,04 (СО); 0,64 (
этой реакции при 727 °С, если равновесные концентрации веществ равны (моль/л): 0,04 (СО); 0,64 (  ); 0,16 (
); 0,16 (  ); 0,16 (
); 0,16 (  ), и установите направление смещения равновесия в системе при понижении температуры. Какая это реакция экзо- или эндотермическая? Как повлияет повышение давления в системе на смещение равновесия и численное значение константы равновесия данной реакции?
), и установите направление смещения равновесия в системе при понижении температуры. Какая это реакция экзо- или эндотермическая? Как повлияет повышение давления в системе на смещение равновесия и численное значение константы равновесия данной реакции?