
|
|
способы получения и природные источникиВВЕДЕНИЕ
Фридрих Август Кекуле определил органическую химию как химию соединений углерода. Но более точное определение органической химии было дано Карлом Шорлеммером в 1889 году: «Органическая химия — это химия углеводородов и их производных».
Органические вещества и в целом, и по отдельности изучаются в той или иной мере различными химическими науками, и не только химическими (химическая технология, биологическая химия, аналитическая химия, микробиология, физика и др.).
Предмет органической химии — это, прежде всего, принципы и законы, определяющие строение органических соединений, их синтез и превращения. И только после этого можно утверждать, что предмет органической химии лишь включает важные в практическом отношении свойства веществ и другие элементы действительности. Алканы
Изомерия
Для насыщенных углеводородов характерна структурная изомерия, точнее, её разновидность — скелетная изомерия, или изомерия углеродного скелета; также характерны различные виды стереоизомерии (конформационная и конфигурационная). Структурными изомерами являются уже углеводороды состава C4H10 . Это бутан и изобутан.
Физические свойства Первые четыре представителя — газы; углеводороды, имеющие от 5 до 15 атомов углерода, — жидкости; высшие — твёрдые тела. Газы не имеют вкуса, цвета и запаха. Жидкости — бесцветны, подвижны, с плотностью 0.8-0.9 г/мл. Твёрдые вещества — белого цвета, жирны на ощупь.
Химические свойства
R–H + X×® HX + R× R× + X2 ® RX + X× Для алканов должны быть характерны реакции радикального замещения (SR).
Реакции радикального замещения
Это прежде всего галогенирование, сульфохлорирование, сульфоокисление, окисление, нитрование.
Хлорирование метана.
Инициирование, или зарождение цепи:
Cl : Cl ® Cl× + Cl×
Cl× + H–CH3 ® HCl + ×CH3 ×CH3 + Cl2 ® CH3Cl + Cl× Cl× + H–CH3 ® HCl + ×CH3
Данные реакции относятся к цепным реакциям.
Для высших алканов схема реакции хлорирования аналогична. Хлорирование этана.
Начиная с пропана углеводороды содержат разные по природе атомы водорода.
продуктами могут быть
1. Статистический фактор. В реакции хлорирования при высокой температуре, когда хлор-радикал очень активен и реагирует с любым атомом, с которым он сталкивается. В этих условиях образуется 75% 1-хлоропропана и 25% 2-хлоропропана.
2. Однако при низкой температуре, когда активность атакующих радикальных частиц в реакции хлорирования значительно ниже, главенствующую роль играет стабильность образующихся углеводородных радикалов. Относительная устойчивость углеводородных радикалов связана с проявляющимися электронными эффектами. Для первичного пропильного радикала смещение электронной плотности к радикальному атому и за счёт индуктивного эффекта, и засчёт эффекта сверхсопряжения меньше, чем для вторичного пропильного радикала.
Индуктивный (индукционный) эффект — смещение поделенной пары электронов s-связи, вызванное различием в электроотрицательности атомов.
Сверхсопряжение — это смещение электронов s-связи С–Н к соседнему атому углерода, имеющему негибридную р-орбиталь. Она может принимать участие в образовании p-связи, а может (как здесь, в частицах, именуемыми свободными радикалами) не принимать участия.
При низкой температуре при хлорировании пропана образуется 55% 2-хлорпропана и 45% 1-хлорпропана:
Оотносительная устойчивость насыщенных углеводородных радикалов уменьшается в ряду: третичные > вторичные > первичные. Но присутствие электроноакцепторных атомов или групп оказывает ингибирующее действие на процесс радикального галогенирования. Например, для 1-хлоробутана Cl-CH2CH2CH2CH3 вероятность замещения водорода (т.е. введения второго атома хлора в молекулу бутана) у третьего углеродного атома в 3 раза выше, чем у второго, и в 17 раз выше, чем у первого.
3. Доступность реакционного центра алкана для атаки реагентом.
Среди других случаев радикального замещения, характерных для насыщенных углеводородов, можно отметить реакции нитрования, сульфохлорирования, сульфоокисления и окисления. Нитрование алканов в газовой фазе при температуре » 450°С или в жидкой фазе по М.И. Коновалову* при температуре около 150° С осуществляется разбавленной азотной кислотой (10-25%-й), содержащей диоксид азота NO2 R-H + HNO3 ® R-NO2 + H2O ,
механизм реакции: R-H + ×NO2 ® R× + HNO2
HNO2 + HNO3 ® 2 ×NO2 + H2O
R× + ×NO2 ® R-NO2 нитроалкан
Жидкофазное нитрование достаточно селективно: из гексана при 150°С образуется 2-нитрогексан с выходом 63%.
Сульфохлорирование алканов протекает по схеме: RH + SO2 + Cl2 ® RSO2Cl + HCl
RSO2 × + Cl2 ® RSO2Cl + Cl× алкансульфохлорид
Сульфохлорирование осуществляется преимущественно по первичным, наиболее доступным, атомам углеродной цепи.
Возможно также сульфоокисление алканов, приводящее к образованиию алкансульфокислот и протекающее по схеме:
RH + SO2 + ½ О2 ® RSO3Н
Окисление алканов по связи C–H под действием атмосферного кислорода — реакция крайне медленная: X–O–O× + RH ® R× + X–O–OH
R× + O2 ® R–O–O×
R–O–O× + RH ® R× + R–O–OH и т.д.
Антиоксиданты добавляют в количестве от 0,001% до 3%; при этом окисление замедляется в десятки раз.
Промышленное окисление высших алканов — кислородом воздуха при 100-150°С в присутствии солей марганца (II) как катализатора, образуется смесь карбоновых кислот: RCH2CH2R¢ + O2 ® R-COOH + R¢-COOH
Алканы вступают также в 2) реакции дегидрирования, 3) разложения, 4) изомеризации— самостоятельно
способы получения и природные источники
При разгонке нефти получаются различные смеси алканов, которые используются в виде следующих фракций: бензин (углеводороды С5—С11), лигроин (углеводороды С8—С14), керосин (углеводороды С12—С18), дизельное топливо (углеводороды С14—С25), смазочные масла (углеводороды С20—С34), вазелин, твёрдый парафин, гудрон. Высшие фракции разгонки нефти подвергают крекингу для получения высокосортных бензинов. Попутными нефтяными газами являются, главным образом, растворённые в нефти метан, этан, пропан, бутан и пентан примерно в равных количествах, но обычно с преобладанием метана (иногда до 50%).
Алканы могут быть получены из метана, который подвергают конверсии с водяным паром на никелевом катализаторе при температуре 700-750° С. CH4 + H2O ® CO + 3 H2
Образующийся при этом синтез-газ в более мягких условиях (в присутствии никелевого или кобальтового катализатора при температуре 180-230° С) превращается в углеводороды и водяной пар: n CO + (2n+1) H2 ® CnH2n+2 + n H2O
Другими синтетическими способами получения алканов являются: Ø гидрирование непредельных углеводородов в присутствии катализатора (Ni, Pt, Pd): СН2=СН2 + Н2 ® СН3СН3 СНºСН + 2 Н2 ® СН3СН3
Ø восстановлением йодоводородом при нагревании производных алканов (йодалканов, спиртов): R–I + HI ® RH + I2 R–OH + 2 HI ® RH + I2 + H2O
Ø из галогеналканов: а) через магнийорганические соединения
R–Br + Mg ® R–MgBr
их гидролизом с сохранением углеродного скелета:
R–MgBr + H2O ® RH + Mg(OH)Br
или по реакции Вюрца*-Гриньяра* с удлинением углеродного скелета: R–MgBr + R’–Br ® R-R’ + MgBr2
б) по реакции Вюрца 2 R–Br + 2 Na ® R–R + 2 NaBr При этом использование реакции Вюрца возможно только для селективного получения симметричных алканов, в противном случае (при использовании смеси исходных галогеналканов) образуется трудноразделимая смесь трёх алканов. Другая особенность получения алканов реакцией Вюрца заключается в невозможности использования для этих целей третичных алкилгалогенидов — вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом, например, для трет-бутилбромида:
Ø при сплавлении солей карбоновых кислот со щелочами в лабораторных условиях при 200-300°С можно получить метан:
и другие низшие алканы; Ø гидролиз карбида алюминия ¾ удобный способ получения метана в лаборатории: Al4C3 + H2O ® CH4 + Al(OH)3
Ø электролиз натриевых и калиевых солей монокарбоновых кислот по Кольбе* ¾ способ получения алканов с чётным числом атомов углерода в молекуле:
R× + × R ® R–R ;
Ø из альдегидов и кетонов по реакции Кижнера*-Вольфа*:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|




 ,
,



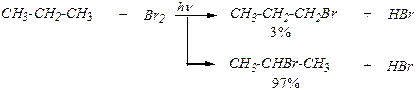


 ,
,
