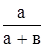|
|
Опыт 1. Получение хлора окислением хлороводородной кислотыЛАБОРАТОРНАЯ РАБОТА ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ Опыт 1. Скорость реакции в гомогенных системах При реакции между серной кислотой и тиосульфатом натрия а) Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4 б) H2S2O3 = H2O + SO2 + S нерастворимая сера выделяется в виде мути. Время от начала реакции до появления первых следов мути зависит от концентрации реагирующих веществ и температуры. Три бюретки порознь наполнить водой, раствором тиосульфата натрия и раствором серной кислоты. В четыре пробирки налить указанное в таблице количество мл раствора тиосульфата натрия и воды. В другие четыре пробирки отмерить из бюретки по 6 мл раствора серной кислоты. Влить в пробирку N 1 отмеренное количество серной кислоты, быстро перемешать и отсчитать по секундомеру время до появления мути. Скорость реакции определить как величину , обратно пропорциональную найденному времени V = 1/т
Произвести такие же опыты со всеми другими пробирками. Зависимость между изменениями концентрации раствора и скорость реакции изобразить графически. График удобно строить на миллиметровой бумаге, на оси абсцисс отложить концентрацию, на оси ординат – скорость реакции. Рекомендуется величину V выразить десятичными дробями до второй значащей цифры, а затем умножить на 100. Удобный масштаб: минимальная концентрация 3 см, максимальная скорость – 8 см. Какой линией выражается найденная зависимость? Проходит ли она через начало координат? Почему?
Опыт 2. Влияние температуры на скорость реакции
В четыре пробирки ( 1, 2, 3, 4) налить из бюретки по 4 мл раствора тиосульфата натрия, а в четыре другие ( 1а, 2а, 3а, 4а) – по 4мл раствора серной кислоты. Все пробирки поместить в стакан с водой. Через 5 мин, измерив температуру воды, слить содержимое пробирок №1 и №1а и отсчитать по секундомеру время до появления мути. Стакан с пробирками нагреть на 100С выше первоначальной температуры и повторить опыт с пробирками №2 и №2а. Провести опыты с остальными пробирками, повышая температуру воды каждый раз еще на 10оС. Данные опытов записать в следующем виде:
Выразить графически влияние температуры на скорость реакции, откладывая на оси абсцисс значение температуры, удобный масштаб:10оС – 2 см, наибольшая скорость реакции – 6 см. Как влияет температура на скорость реакции? Проходит ли кривая "скорость-температура" через начало координат?
Опыт 3. Химическое равновесие
Примером обратимой реакции является взаимодействие между хлоридом железа (Ш) и роданидом калия. Образующийся в результате реакции раствор роданистого железа Fe(CNS)3 обладает красным цветом, интенсивность которого зависит от концентрации. Смещение равновесия легко наблюдать по изменению интенсивности окраски раствора. В стаканчик налить 20 мл воды и добавить по 1-2 капли насыщенных растворов FeCI3 и KCNS. Окрашенный в красный цвет раствор разлить поровну в 4 пробирки. Составить уравнение обратимой реакции и выражение константы равновесия. В одну пробирку добавить 2-3 капли насыщенного раствора FeCI3. Что наблюдается? Дать объяснения, исходя из уравнения константы равновесия. В другую пробирку прилить 2-3 капли насыщенного раствора KCNS. Дать объяснения наблюдаемому изменению. Чем объясняется, что изменение концентрации KCNS вызывает более эффективное равновесие, чем изменение концентрации FeCI3? В третью пробирку немного добавить твердого хлористого калия, сильно взболтать. Сравнить цвета растворов в 3 и 4 пробирках. Дать объяснения. Как надо изменить концентрацию веществ, чтобы сместить равновесие вправо или влево? ( 4-ю пробирку оставить для опыта 4).
ъ
Опыт 4. Влияние катализаторов на скорость реакции а) Гетерогенный катализ. В три пробирки налить по 1 мл раствора перекиси водорода и прибавить одновременно: в одну – щепотку двуокиси марганца, в другую – такое же количество окиси железа, в третью – двуокиси кремния. Наблюдать разложение перекиси водорода с выделением кислорода ( проба тлеющей лучиной). Одинаково ли быстро протекает процесс? Напишите уравнения реакций. б) Гомогенный катализ. Раствор роданида железа, оставшийся после опыта 3, разбавить двойным объемом воды и разлить поровну в три пробирки. Отмерить цилиндром 5 мл раствора тиосульфата натрия, влить в первую пробирку, включив в момент вливания секундомер. Отметить время от момента вливания до обесцвечивания раствора. Реакция протекает согласно уравнению:
2Fe(CNS)3 + 2Na2S2O3 = 2Fe(CNS)2 + 2 NaCNS + Na2S4O6
Все вещества, образующиеся в результате реакции, бесцветны. Во вторую пробирку добавить 5 капель раствора сульфата меди и влить 5 мл раствора тиосульфата натрия. Определить по секундомеру время от момента сливания растворов до обесцвечивания. Какую роль играют ионы Сu2+? В третью пробирку влить 15 капель сульфата меди и проделать аналогичный опыт. Как влияет количество катализаторов на скорость катализируемой гомогенной реакции?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется скоростью химической реакции? В каких единицах она измеряется? 2. В чем различие реакций, происходящих в гомогенных системах и гетерогенных системах? 3. Почему при повышении концентрации реагирующих веществ и температуры скорость реакции увеличивается? 4. Какое состояние реакционной химической системы называется химическим равновесием? Почему химическое равновесие называют подвижным (динамическим)? 5. Какие методы ускорения течения реакций существуют? Что называется катализом? 6. Какова роль катализатора в химической реакции? Влияет ли катализатор на состояние химического равновесия?
ЛАБОРАТОРНАЯ РАБОТА
Галогены
Опыт 1. Получение хлора окислением хлороводородной кислоты
Выполнение работы. В две пробирки раздельно внести по 2-3 кристаллика КМnО4 и К2Сr2О7. В обе пробирки добавить по 2-3 капли концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Вторую пробирку слегка подогреть. Наблюдать выделение хлора. Пробирку с выделяющимся хлором быстро закрыть пробкой с газоотводной трубкой и опустить конец капиллярной трубки в коническую пробирку с водой. Хлор пропускать в воду 3-4 мин. Пробирку с полученной хлорной водой закрыть пробкой и сохранить для последующих опытов. Запись данных опыта. Отметить окраску хлора. Написать уравнения протекающих реакций, учитывая, что дихромат калия переходит в хлорид хрома (III), а перманганат калия - в хлорид марганца (II). Указать окислитель и восстановитель.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|