
|
|
Определение константы скорости гидролизаМ И Н И С Т Е Р С Т В О К У Л Ь Т У Р Ы Р О С С И И
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ КИНО И ТЕЛЕВИДЕНИЯ Кафедра общей, органической и физической химии
ФИЗИЧЕСКАЯ ХИМИЯ
Методические указания по выполнению лабораторных работ для студентов специальности 240504. "Технология кинофотоматериалов и магнитных носителей" дневного и заочного отделений. Часть IV. Кинетика химических реакций.
Санкт-Петербург
Составитель: Л.Л. Кузнецов Рецензент: В.В. Митрофанов
Рекомендовано к изданию в качестве методических указаний по лабораторному практикуму по физической химии кафедрой общей, органической и физической химии.
Протокол заседания кафедры общей, органической и физической химии № 2 от 12 ноября 2008 г.
ã СПбГУКиТ 2009 г. Теоретическое введение к работам № 15 и № 16
1. Скорость химической реакции
Рассмотрим одностороннюю химическую реакцию
a A + b B → c C + d D.
Пусть в начальный момент времени, при τ = 0, количества веществ A, B, C и D составляют соответственно
где ν – стехиометрический коэффициент для i-го реагента, взятый со знаком минус для исходного или со знаком плюс для конечного продукта реакции. Величина Скоростью химической реакции называется скорость изменения химической переменной, то есть тангенс угла наклона касательной, проведенной к графику зависимости химической переменной от времени:
где Поскольку скорость реакции зависит от количеств молей веществ, принимающих участие в реакции, а значит от объема реакционной массы, на практике пользуются удельными скоростями реакции, отнесенными к единице объема V:
Рис.1. Зависимость величины химической переменной (а) и скорости реакции (б) от времени протекания реакции.
Удельной скоростью реакции называется количество молей вещества, образующееся или распадающееся в единице объема за единицу времени, деленное на стехиометрический коэффициент перед символом этого вещества в уравнении химической реакции. Поскольку количество молей вещества равно произведению его молярной концентрации на объем реакционной массы (
Для реакций протекающих без заметного изменения объема (V=const и dV=0) скорость равна изменению молярной концентрации реагента в единицу времени, деленному на стехиометрический коэффициент:
Величина
2. Зависимость скорости реакции от концентраций реагирующих веществ
Согласно основному постулату химической кинетикискорость химической реакции пропорциональна концентрациям реагирующих веществ, взятых в степенях, называемых формальными частными порядками по концентрациям реагентов. Так, для реакции а А + b B → c C + d D
удельная скорость определяется выражением
Это выражение называется кинетическим уравнением. Оно связывает скорость реакции и концентрации исходных веществ. Показатели степени n и m называются частными порядками по концентрациям веществ А и В. Они не имеют строгого физического смысла, их величины определяются механизмом реакции. Частные порядки показывают лишь в какой степени скорость реакции зависит от изменения концентраций реагентов. Чаще всего они не равны стехиометрическим коэффициентам a и b и могут быть равными нулю, а также принимать как целые, так и дробные значения. Общим порядком реакции называется сумма частных порядков (n + m). Для простейших одностадийных реакций частные порядки совпадают со стехиометрическими коэффициентами (n = a и m = b). Коэффициент пропорциональности между удельной скоростью и концентрациями реагентов называется константой скорости реакции (k). Она численно равна удельной скорости химической реакции при концентрациях реагентов равных 1 моль/л. Ее величина зависит от реакционной способности реагирующих веществ и механизма реакции, а также от условий протекания реакции – от природы растворителя, наличия катализаторов и температуры.
3. Зависимость скорости реакции от температуры.
Согласно теории соударения, химическая реакция протекает только при столкновении реагирующих частиц. Если суммарная энергия столкновения больше некоторой величины, называемой энергией активации, такое соударение называется активным. Оно может закончиться химической реакцией. Если энергия соударения меньше энергии активации - частицы разлетаются без химического изменения. Обычно далеко не каждое активное соударение приводит к химической реакции. Для этого оно должно произойти так называемыми реакционными центрами. Зависимость константы скорости реакции от температуры описывается уравнением Аррениуса:
где А – предэкспоненциальный множитель;
Здесь
РАБОТА № 15
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ ПЕРВОГО ПОРЯДКА ДЛЯ РЕАКЦИИ ГИДРОЛИЗА (ИНВЕРСИИ) САХАРОЗЫ.
Целью работы является определение константы скорости реакции гидролиза сахарозы, катализируемой кислотой и проводимой в большом избытке воды, то есть в условиях протекания реакции по общему первому порядку. Мерой изменения концентрации реагентов и продуктов реакции является изменение угла вращения плоскости поляризации плоскополяризованного света при прохождении его через реакционную среду.
1. Теоретическая часть
1.1. Односторонние реакции первого порядка.
Односторонними называются реакции, протекающие до полного расходования одного или нескольких исходных веществ, что связано с отсутствием обратной реакции. Реакциями общего первого порядка являются, во-первых, мономолекулярные реакции типа
для которых кинетическое уравнение записывается следующим образом:
Как реакции первого порядка протекают также бимолекулярные реакции
скорость которых связана с концентрациями реагирующих веществ кинетическим уравнением общего второго порядка
Если один из реагентов, например вещество B, взят в большом избытке, то есть если (
где Разделение переменных в дифференциальной форме кинетического уравнения первого порядка (1) позволяет провести его интегрирование и получить интегральную форму:
откуда:
или
Из (2) следует, также
Поскольку из одного моля вещества А образуется один моль вещества В, то
Уравнения (3-5) отражают зависимости концентраций исходного вещества А и продукта реакции В от времени протекания реакции. В графической форме эти зависимости приведены на рис.2, из которого следует, что характерной особенностью реакции первого порядка является линейность графика изменения концентрации исходного вещества со временем в координатах ln[A] - t. Другой особенностью реакции первого порядка является независимость времени полупревращения (
Отсюда следует, что при первом порядке время полупревращения не зависит от начальной концентрации исходного вещества. Чем больше константа скорости, тем время полупревращения меньше.
Рис.2. Зависимость концентрации исходного вещества А и продукта реакции В от времени протекания реакции.
Для нахождения константы скорости реакции достаточно, зная начальную концентрацию исходного вещества (
Другим способом вычисления константы скорости первого порядка является нахождение тангенса угла наклона линейного графика ln[A] - t или lg[A] - t (см. рис.2а). Определение константы скорости первого порядка возможно, также, путем измерения концентрации не исходного вещества, а продукта реакции. Поскольку
Для определения константы скорости первого порядка необходимо измерить концентрацию продукта реакции в момент времени t после начала реакции (
2. Определение константы скорости реакции гидролиза сахарозы.
2.1. Кинетика гидролиза сахарозы. Сахароза C12H22O11 является дисахаридом, в котором остатки глюкозы и фруктозы связаны простой эфирной связью. При кислотном гидролизе сахароза образует смесь равных количеств глюкозы и фруктозы:
Сахароза Глюкоза Фруктоза ,
или
В отсутствие кислот гидролиз протекает с заметной скоростью только под действием фермента инвертазы. Гидролиз является бимолекулярной реакцией, кинетическое уравнение которой соответствует общему второму порядку:
В условиях проведения работы № 15 начальная концентрация воды много больше начальной концентрации сахарозы (
где
Определение концентрации сахарозы во время протекания гидролиза легко может быть проведено путем измерения угла вращения плоскости поляризации плоскополяризованного света, проходящего через реакционную массу. Это возможно потому, что сахароза является оптически активным веществом (оптически активными являются все вещества, содержащие асимметрические атомы углерода, связанные с четырьмя различными заместителями). В соответствии с законом Био, угол поворота плоскости поляризации при прохождении плоскополяризованного света через раствор оптически активного вещества пропорционален концентрации раствора и толщине его слоя:
Здесь Поскольку оптически активной является не только сахароза, но и продукты ее гидролиза – глюкоза и фруктоза, наблюдаемый угол вращения плоскости поляризации всегда является суммой углов вращения, обусловленной всеми тремя веществами. Если в начальный момент времени угол вращения плоскости поляризации составляет
Отсюда
Если подставить значения
Таким образом, для вычисления константы скорости необходимо определить угол вращения плоскости поляризации смесью раствора сахара с раствором катализирующей кислоты в момент начала реакции, то есть в момент их смешения (
поэтому кроме вычисления по уравнению (8), константу скорости гидролиза можно определить из наклона так называемой полулогарифмической анаморфозы реакции, то есть линейного графика зависимости
Измерение угла поворота плоскости поляризации проводят при помощи поляриметра при длине волны, соответствующей линии D спектра излучения натрия (см. следующий раздел). Мольное вращение при освещении натриевой лампой (
2.2. Измерение углов вращения плоскости поляризации.
Эти измерения проводят с помощью прибора, называемого поляриметром. Основой прибора являются два поляризационных фильтра. Один фильтр поляризует пучок света от натриевой газосветной лампы в строго ориентированной плоскости. После прохождения поляризованного света через раствор оптически активного вещества, помещенного в поляриметрическую трубку определенной длины, плоскость поляризации поворачивается либо вправо (положительный угол), либо влево (отрицательный). Второй фильтр, называемый анализатором, расположен перед окуляром, через который проводится наблюдение за интенсивностью прошедшего через раствор света. Анализатор можно поворачивать с помощью специального маховичка в ту или другую сторону. При этом происходит изменение относительной освещенности двух полей видимых в окуляр. Положение анализатора связано с круговой шкалой. Отсчет проводят в положении равной освещенности двух видимых в окуляр полей:
Цена деления круговой шкалы лимба поляриметра составляет 0.5 градуса. С помощью нониусной шкалы каждое деление шкалы лимба можно разделить еще на 25 частей. Таким образом, отсчет результата измерения можно провести с точностью до ±0.02 градуса. Примеры отсчета приведены ниже:
Как показано на рисунке, отсчет с точностью до 0.5° производится по нулевому делению нониусной шкалы. К отсчету добавляют десятые и сотые доли градуса, соответствующие совпадающим рискам нониусной шкалы. Перед измерениями определяют инструментальную поправку прибора. Для этого в поляриметрическую трубку заливают дистиллированную воду, не обладающую оптической активностью, и проводят измерение угла вращения. Для повышения точности, измерение проводят несколько раз и получают из них среднее арифметическое:
Все измерения, проводимые с помощью данного поляриметра, неизбежно включают поправку прибора:
Поскольку гидролиз начинается в момент смешения раствора сахара с раствором кислоты, а значит непосредственное измерение
Измерение угла вращения плоскости поляризации во время гидролиза ( Конечный угол вращения плоскости поляризации (
2.3. Проведение работы и обработка полученных результатов.
2.3.1. Заполнить поляриметрическую трубку дистиллированной водой (налить с образованием выпуклого мениска и закрыть стеклом, надвинув его сбоку так, чтобы в объеме не образовался воздушный пузырь). 2.3.2. Установить в поляриметр трубку с дистиллированной водой и 5 раз измерить величину инструментальной поправки ( 2.3.3. Как в п. 2.3.1. заполнить трубку исходным раствором сахарозы и 5 раз измерить угол вращения плоскости поляризации; найти среднее арифметическое и, вычтя поправку 2.3.4. Отмерить в колбу 25 мл раствора сахарозы и добавить к нему 25 мл раствора кислоты; записать время смешения, то есть время начала реакции, с точностью до минуты. 2.3.5. Тщательно перемешать полученный раствор и заполнить им поляриметрическую трубку. После заполнения поляриметрической трубки поместить колбу с реакционной массой в баню с водой, нагретую до 60°С. 2.3.6. Установить трубку в поляриметр и через 5 мин после начала реакции измерить угол вращения плоскости поляризации. Последующие измерения провести через 10, 15, 20, 30, 45 и 60 мин после начала реакции. Внести полученные данные в таблицу. 2.3.7. После нагревания реакционной массы в течение часа при 60±5°С колбу с реакционной массой охлаждают до комнатной температуры, наполняют реакционной массой поляриметрическую трубку и 5 раз измеряют конечное значение угла поворота плоскости поляризации; вычитают из среднего арифметического величину инструментальной поправки и записывают значение 2.3.8. Вычисляют значения (
Таблица
Среднее значение k =
Контрольные вопросы к теме: "Определение константы скорости первого порядка гидролиза (инверсии) сахарозы".
1. Скорость химической реакции, единицы ее измерения. Удельная скорость химической реакции. 2. Зависимость скорости реакции от концентраций исходных веществ и от температуры. Общий и частные порядки реакции. 3. Односторонние реакции первого порядка. Вывод интегральной формы кинетического уравнения реакции, зависимость концентрации исходных веществ и продуктов от времени протекания реакции. 4. Кислотнокатализируемый гидролиз сахарозы. Кинетическое уравнение реакции. 5. Связь угла вращения плоскости поляризации света с концентрацией оптически активного вещества (закон Био). 6. Методика определения константы скорости гидролиза сахарозы.
Литература
1. Физическая химия/Под ред. К.С. Краснова. -М.: Высшая школа. 1982, С. 521-603. 2. Практические работы по физической химии /Под ред. К.П.Мищенко, А.А.Равделя, А.М.Пономаревой. -Л.: Химия. 1982. С. 217-222; 248−253. 3. Стромберг А.Г., Семченко Д.П. Физическая химия.-М.: Высшая школа. 1988. С. 296-315.
РАБОТА № 16
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ ВТОРОГО ПОРЯДКА ДЛЯ ОМЫЛЕНИЯ СЛОЖНОГО ЭФИРА
Целью работы является определение константы скорости щелочного гидролиза сложного эфира, протекающего в соответствии с кинетическим уравнением реакции второго порядка. Определение проводится путем наблюдения за изменением концентрации щелочи во времени.
Теоретическая часть
1.1. Односторонние реакции второго порядка.
Односторонними реакциями общего второго порядка обычно являются бимолекулярные реакции типа
для которых дифференциальная форма кинетического уравнения реакции имеет вид:
Пусть в начальный момент времени (
Интегральную форму кинетического уравнения реакции второго порядка можно получить после разделения переменных и интегрирования:
Поскольку
то в результате интегрирования получается следующее выражение:
С учетом того, что
Таким образом, для нахождения константы скорости реакции второго порядка необходимо, зная начальные концентрации исходных веществ ( Из (2) следует:
откуда
Таким образом, характерной особенностью реакций второго порядка является линейность графика зависимости логарифма отношения концентраций исходных веществ от времени. Наклон этого графика зависит от того, какой из компонентов берется в избытке. Если
Рис. 1. Зависимость отношения концентраций исходных веществ от времени для реакции второго порядка при
Из рис. 1 следует, что константу скорости реакции второго порядка легко определить из наклона графика ln([B]/[A]) от времени.
Зависимости концентраций исходных веществ А и В от времени являются нелинейными, причем разность их концентраций в ходе реакции остается постоянной ( Зависимости концентраций веществ А и В от времени в этом случае имеют вид, показанный на рис. 2. Частным случаем реакции второго порядка является равенство начальных концентраций реагентов, когда
или
Такое же кинетическое уравнение описывает зависимость скорости реакции от концентрации исходных веществ и в случае, когда протекает бимолекулярная реакция типа
Разделение переменных в уравнении (3) и последующее интегрирование дает интегральную форму кинетического уравнения реакции второго порядка:
или окончательно:
Из (4) следует, что зависимость концентрации исходного вещества от времени в этом случае является линейной в координатах 1/[A] - t , как это показано на рис. 3. Наклон линейного графика равен константе скорости реакции второго порядка, поэтому ее величина может быть найдена графическим способом, или аналитически из уравнения (4):
Следовательно, для определения константы скорости необходимо, зная начальную концентрацию исходного вещества ( 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ,
,  ,
,  и
и  . По мере протекания реакции количество исходных веществ A и B убывает, а продуктов реакции - веществ C и D - возрастает. В момент времени
. По мере протекания реакции количество исходных веществ A и B убывает, а продуктов реакции - веществ C и D - возрастает. В момент времени  они составляют соответственно
они составляют соответственно  ,
,  ,
, 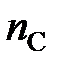 и
и  . Поскольку в общем случае стехиометрические коэффициенты в уравнении химической реакции не одинаковы
. Поскольку в общем случае стехиометрические коэффициенты в уравнении химической реакции не одинаковы 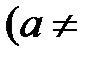
 ), изменения количеств молей реагентов за время τ также не равны друг другу:
), изменения количеств молей реагентов за время τ также не равны друг другу: 
 . В то же время, если изменения количеств реагентов разделить на стехиометрические коэффициенты, причем для исходных веществ взять их со знаком минус, а для продуктов реакции со знаком плюс, полученные величины в любой момент времени будут равны друг другу:
. В то же время, если изменения количеств реагентов разделить на стехиометрические коэффициенты, причем для исходных веществ взять их со знаком минус, а для продуктов реакции со знаком плюс, полученные величины в любой момент времени будут равны друг другу: ,
, , которая всегда положительна, называется химической переменной. По мере протекания реакции химическая переменная растет от нуля до некоторой предельной величины, которая становится равной
, которая всегда положительна, называется химической переменной. По мере протекания реакции химическая переменная растет от нуля до некоторой предельной величины, которая становится равной  после окончания реакции (рис.1).
после окончания реакции (рис.1). , моль/с,
, моль/с, .- стехиометрический коэффициент в уравнении химической реакции для данного компонента, взятый со знаком минус для исходного вещества и со знаком плюс для продукта реакции. Из рис.1 следует, что по мере протекания реакции ее скорость убывает от некоторой максимальной величины до нуля.
.- стехиометрический коэффициент в уравнении химической реакции для данного компонента, взятый со знаком минус для исходного вещества и со знаком плюс для продукта реакции. Из рис.1 следует, что по мере протекания реакции ее скорость убывает от некоторой максимальной величины до нуля. , моль/л×с.
, моль/л×с.
 ), удельная скорость реакции определяется выражением:
), удельная скорость реакции определяется выражением: , моль/л×с.
, моль/л×с. .
. может быть как положительной (для продукта реакции), так и отрицательной (для исходного вещества), однако скорость реакции всегда больше нуля.
может быть как положительной (для продукта реакции), так и отрицательной (для исходного вещества), однако скорость реакции всегда больше нуля. .
. , или
, или  ,
, – энергия активации реакции; R и T – универсальная газовая постоянная и температура в градусах Кельвина соответственно. Чем больше энергия активации, тем в большей степени константа скорости и скорость реакции зависят от температуры. Для большинства химических реакций, протекающих с заметной скоростью при обычных температурах, величина энергии активации составляет 60-100 кДж/моль, поэтому чаще всего при увеличении температуры на 10 градусов константа скорости реакции возрастает в 2-4 раза. Согласно так называемому правилу Вант-Гоффа:
– энергия активации реакции; R и T – универсальная газовая постоянная и температура в градусах Кельвина соответственно. Чем больше энергия активации, тем в большей степени константа скорости и скорость реакции зависят от температуры. Для большинства химических реакций, протекающих с заметной скоростью при обычных температурах, величина энергии активации составляет 60-100 кДж/моль, поэтому чаще всего при увеличении температуры на 10 градусов константа скорости реакции возрастает в 2-4 раза. Согласно так называемому правилу Вант-Гоффа:
 - коэффициент Вант-Гоффа.
- коэффициент Вант-Гоффа. ,
, .
. ,
, .
. ), его концентрация вплоть до полного завершения реакции остается постоянной и равной исходной:
), его концентрация вплоть до полного завершения реакции остается постоянной и равной исходной:  . В этих условиях кинетическое уравнение можно переписать как:
. В этих условиях кинетическое уравнение можно переписать как: , (1)
, (1) - константа скорости второго порядка, а
- константа скорости второго порядка, а  - константа скорости первого порядка.
- константа скорости первого порядка. ;
;  ;
;  ,
, ;
;  , (2)
, (2) . (3)
. (3) , или
, или  . (4)
. (4) . Если подставить сюда значение [A] из (4) можно получить:
. Если подставить сюда значение [A] из (4) можно получить: . (5)
. (5) ) от начальной концентрации исходного вещества. Действительно, поскольку время полупревращения это то время, за которое начальная концентрация исходного вещества уменьшается вдвое, то при t =
) от начальной концентрации исходного вещества. Действительно, поскольку время полупревращения это то время, за которое начальная концентрация исходного вещества уменьшается вдвое, то при t =  величина
величина  . Подстановка значений t и [A] в уравнение (2) дает:
. Подстановка значений t и [A] в уравнение (2) дает: , откуда
, откуда  , с.
, с.
 ) измерить его концентрацию (
) измерить его концентрацию (  )при времени t. Так, из (2) следует:
)при времени t. Так, из (2) следует: , с-1. (6)
, с-1. (6) (см. ранее), а
(см. ранее), а  (рис.2б), подстановка значений
(рис.2б), подстановка значений  и
и  в уравнение (6) дает:
в уравнение (6) дает: .
. ) и после ее завершения (
) и после ее завершения (  ).
).
 .
. .
. ), поэтому в ходе реакции концентрация воды остается практически постоянной и равной начальной (
), поэтому в ходе реакции концентрация воды остается практически постоянной и равной начальной (  ). В соответствии с этим, кинетическое уравнение можно переписать следующим образом:
). В соответствии с этим, кинетическое уравнение можно переписать следующим образом: ,
, - константа скорости первого порядка. Для ее вычисления, в соответствии с уравнением (6), необходимо отдельно определить начальную концентрацию сахарозы и ее концентрацию в момент времени t после начала реакции:
- константа скорости первого порядка. Для ее вычисления, в соответствии с уравнением (6), необходимо отдельно определить начальную концентрацию сахарозы и ее концентрацию в момент времени t после начала реакции: . (7)
. (7) , град.
, град. , град×л/моль×см - мольное вращение, величина которого зависит от природы оптически активного вещества, растворителя, температуры и длины волны.
, град×л/моль×см - мольное вращение, величина которого зависит от природы оптически активного вещества, растворителя, температуры и длины волны. , а по окончании реакции
, а по окончании реакции  , то при времени
, то при времени  от начала реакции вращение, обусловленное сахарозой составит
от начала реакции вращение, обусловленное сахарозой составит  , где
, где  - доля негидролизованной сахарозы. В тот же момент времени
- доля негидролизованной сахарозы. В тот же момент времени  , а вращение, обусловленное продуктами гидролиза будет равно соответственно
, а вращение, обусловленное продуктами гидролиза будет равно соответственно  . Суммарно угол вращения при времени
. Суммарно угол вращения при времени  .
. , а доля негидролизованной сахарозы и ее концентрация составят соответственно:
, а доля негидролизованной сахарозы и ее концентрация составят соответственно: и
и
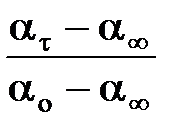 .
. и
и 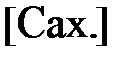 в выражение для константы скорости гидролиза сахарозы (7) можно получить:
в выражение для константы скорости гидролиза сахарозы (7) можно получить: , мин-1 (8).
, мин-1 (8). ), через время t после начала реакции (
), через время t после начала реакции (  ) и после окончания реакции (
) и после окончания реакции (  ). Из (8) следует:
). Из (8) следует: ,
, от времени τ (рис.3).
от времени τ (рис.3).
 ) составляет для сахарозы +227.6, для глюкозы +94.6 и для фруктозы -165.6 град×л/моль×см. По этой причине смесь равных количеств глюкозы и фруктозы вращает плоскость поляризации влево (суммарное мольное вращение такой смеси составляет -71 град×л/моль×см.) и, следовательно, гидролиз сахарозы сопровождается изменением угла вращения плоскости поляризации (рис.4) от положительного значения (
) составляет для сахарозы +227.6, для глюкозы +94.6 и для фруктозы -165.6 град×л/моль×см. По этой причине смесь равных количеств глюкозы и фруктозы вращает плоскость поляризации влево (суммарное мольное вращение такой смеси составляет -71 град×л/моль×см.) и, следовательно, гидролиз сахарозы сопровождается изменением угла вращения плоскости поляризации (рис.4) от положительного значения (  -для исходного раствора сахарозы) через нуль к отрицательному значению (
-для исходного раствора сахарозы) через нуль к отрицательному значению ( 

 .
. , поэтому результат любого измерения должен быть скорректирован на величину поправки:
, поэтому результат любого измерения должен быть скорректирован на величину поправки: .
. невозможно, эту величину вычисляют с учетом разбавления исходного раствора сахара раствором кислоты. Для этого измеряют угол вращения для исходного раствора сахара (измерение проводят несколько раз, находят среднее арифметическое и корректируют на поправку прибора). Полученное значение (
невозможно, эту величину вычисляют с учетом разбавления исходного раствора сахара раствором кислоты. Для этого измеряют угол вращения для исходного раствора сахара (измерение проводят несколько раз, находят среднее арифметическое и корректируют на поправку прибора). Полученное значение (  ) умножают на степень разбавления:
) умножают на степень разбавления: .
. от времени и вычислить величину константы скорости из наклона полулогарифмической анаморфозы (см. рис.3).
от времени и вычислить величину константы скорости из наклона полулогарифмической анаморфозы (см. рис.3).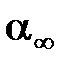 ) измеряют после нагревания смеси раствора сахарозы с раствором кислоты (для завершения гидролиза) в течение часа при 60°С и охлаждения до комнатной температуры.
) измеряют после нагревания смеси раствора сахарозы с раствором кислоты (для завершения гидролиза) в течение часа при 60°С и охлаждения до комнатной температуры. ); найти среднее арифметическое (
); найти среднее арифметическое (  ).
). , вычислить значение
, вычислить значение  .и αо , записать значение αо в таблицу.
.и αо , записать значение αо в таблицу. ), (
), (  ), lg(
), lg(  )
)
 ,
, . (1)
. (1) ) концентрации исходных веществ равны соответственно
) концентрации исходных веществ равны соответственно  и
и  . После начала реакции, при
. После начала реакции, при  , концентрации исходных веществ уменьшатся на одну и ту же величину (x) и составят
, концентрации исходных веществ уменьшатся на одну и ту же величину (x) и составят  и
и  , соответственно. Подставив в уравнение (1) значения концентраций веществ А и В можно получить его дифференциальную форму:
, соответственно. Подставив в уравнение (1) значения концентраций веществ А и В можно получить его дифференциальную форму: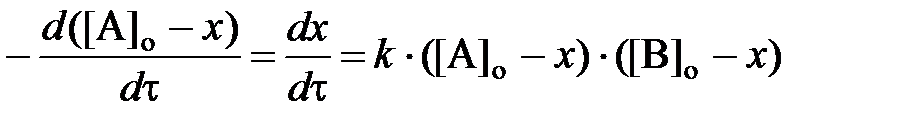 .
. ;
;  .
. ,
, .
. , а
, а  , выражение для константы скорости второго порядка принимает вид:
, выражение для константы скорости второго порядка принимает вид: , л×моль-1×мин-1 . (2)
, л×моль-1×мин-1 . (2) и
и  и
и  ).
). ,
, .
. , то отношение [B]/[A] растет со временем, если в избытке вещество A, то есть когда
, то отношение [B]/[A] растет со временем, если в избытке вещество A, то есть когда  , эта величина уменьшается (рис 1а и 1б).
, эта величина уменьшается (рис 1а и 1б).
 (избыток вещества В).
(избыток вещества В).
 ). Если начальная концентрация вещества В больше начальной концентрации вещества А, то есть вещество В взято в избытке, по окончании реакции вещество А израсходуется полностью (
). Если начальная концентрация вещества В больше начальной концентрации вещества А, то есть вещество В взято в избытке, по окончании реакции вещество А израсходуется полностью (  = 0).
= 0).  Поэтому, поскольку
Поэтому, поскольку  = const, то конечная концентрация вещества В оказывается равной разнице начальных концентраций реагентов:
= const, то конечная концентрация вещества В оказывается равной разнице начальных концентраций реагентов:  .
. . В этом случае на протяжении всей реакции концентрации реагентов равны друг другу (
. В этом случае на протяжении всей реакции концентрации реагентов равны друг другу (  ) и кинетическое уравнение реакции (1) можно переписать как:
) и кинетическое уравнение реакции (1) можно переписать как: ,
, . (3)
. (3) .
. ;
;  ;
;  ,
, . (4)
. (4)
 .
. ) в момент времени t.
) в момент времени t.