
|
|
ВЛИЯНИЕ ИЗМЕНЕНИЯ ВНЕШНИХ УСЛОВИЙ НА СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯПосле изменения внешних условий состояние химического равновесия нарушается, т.к. скорости прямой и обратной реакций в разной степени зависят от этих изменений. Происходит сдвиг равновесия в сторону прямой (вправо) или обратной (влево) реакции, после чего в системе установится новое состояние равновесия, при котором равновесные концентрации реагентов будут отличны от предыдущих. В качественной форме, направление смещения равновесия можно определить, пользуясь принципом Ле Шателье: «Если на систему (реакцию), находящуюся в состоянии равновесия оказать какое-либо внешнее воздействие, то равновесие сместится в том направлении, при котором это воздействие уменьшается». Иными словами равновесная система стремится сохранить старое состояние равновесия и противодействует внешнему воздействию. К наиболее очевидным факторам, способным повлиять на состояние химического равновесия, относятся температура и концентрация реагентов. Для реакций, протекающих с участием газов при постоянной температуре, дополнительным фактором является давление, т.к. его изменение приводит к изменению объема и, следовательно, к изменению концентрации газовых реагентов, причем в разной степени для исходных веществ и продуктов реакции. Рассмотрим влияние этих факторов на смещение равновесия в системе: N2(г) + 3H2(г) ⇄ 2NH3(г) , DНхр< 0 (I)
1. Влияние давления. При повышении давления равновесие в системе смещается в сторону меньшего количества молей газообразных веществ. В данной системе произойдет смещение равновесия вправо, т.е. в сторону прямой реакции. И наоборот, при уменьшении давления равновесие в системе смещается в сторону большего количества молей газообразных веществ. В данной системе произойдет смещение равновесия влево, т.е. в сторону обратной реакции. При изменении давления в системе не произойдет смещения равновесия, если количество моль газообразных веществ в ходе реакции не изменяется. 2. Влияние концентрации реагентов. Изменение концентрации одного или нескольких реагентов в равновесной смеси приведет к смещению равновесия, причем увеличение концентрации исходных веществ сдвигает равновесие вправо, что увеличивает выход продуктов. К такому же эффекту приводит отвод продуктов из равновесной смеси (например, сжижение аммиака и откачка его из реактора). Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т.е. в сторону исходных веществ. 3. Влияние температуры. По отношению к обратимым химическим процессам повышение температуры вызывает сдвиг равновесия в сторону реакции, протекающей с поглощением тепла (эндотермической реакции), понижение температуры – в сторону реакции, протекающей с выделением тепла (экзотермической реакции). Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением DG0х.р. = - RT lnKp, а DG0х.р. = DН0х.р. - Т∙DS0х.р. Тогда lnKp =
Для реакции (I), протекающей с выделением тепла (DНхр<0), увеличение температуры приведет к уменьшению Кр. Это значит, что количество продуктов реакции уменьшится, а количество исходных веществ увеличится, т.е. равновесие сместится влево, т.к. обратная реакция протекает с поглощением тепла. И наоборот, для реакции, протекающей с поглощением тепла (DНхр>0), при увеличении температуры Кр увеличится, т.е. равновесие сместится вправо (в сторону эндотермической реакции). Таким образом, при увеличении температуры константа равновесия эндотермической реакции (DНхр>0) увеличивается, а зкзотермической реакции (DНхр<0) – уменьшается. ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ Задача 1 Как изменится скорость прямой реакции (Т=const) 2SO2(г) + O2(г) ⇄ 2SO3(г) при увеличении общего давления в реакционном сосуде в три раза? Решение. Из уравнения Клапейрона–Менделеева следует, что p = n/V∙RT = CRT, где С - концентрация в моль/л. Согласно закону действующих масс скорость прямой реакции до повышения давления Уравнение скорости прямой реакции будет иметь следующий вид: Задача 2 Для реакции 2NO2(г) ⇄ 2NO(г) + O2(г) константа скорости прямой реакции при 600К равна 83,9 л/моль∙с, а при 645К она составляет 407л/моль∙с. Рассчитать энергию активации этого процесса. Решение. Константа скорости реакции связана с энергией активации уравнением Аррениуса
в котором предэкспоненциальный множитель А0 и энергия активации Еа считаются независимыми от температуры. Перейдя к десятичным логарифмам и прологарифмировав уравнение, получим lgk = Еа= Задача 3 При 5000С равновесие реакции N2(г) + 3H2(г) ⇄ 2NH3(г) установилось при следующих концентрациях (моль/л) реагентов: [N2] = 1,8; [H2] = 7,4; [NH3] = 0,4. Определить: а) исходные концентрации азота и водорода; б) давление в реакционном сосуде в начальный момент и в момент наступления равновесия. Решение. Обозначим исходные концентрации веществ как [N2]исх, [H2]исх. Часть исходных веществ, прореагировавших к моменту наступления равновесия как [N2]изр, [H2]изр, а равновесные концентрации как [N2]равн, [H2]равн, [NH3]равн. В начальный момент времени в реакционной смеси присутствуют только азот и водород в начальных концентрациях. В процессе реакции их концентрации убывают, а концентрация аммиака увеличивается. После установления равновесия (когда скорости прямой и обратной реакций равны) в равновесной смеси присутствуют не успевшие прореагировать азот и водород и успевший образоваться аммиак, таким образом равновесные концентрации исходных веществ будут равны разности между их исходными концентрациями и тем количеством, которое прореагировало к моменту равновесия [N2]равн = [N2]исх - [N2]изр; [H2]равн = [H2]исх - [H2]изр. Равновесные концентрации всех веществ даны в условии задачи, остается определить количества азота и водорода прореагировавших к моменту равновесия. Из уравнения реакции следует, что на каждые 2 моля образовавшегося аммиака затрачивается 1 моль азота и три моля водорода. По условию задачи к моменту равновесия успело образоваться 0,4 моля аммиака. Для этого потребовалось: из 3 молей [H2] образуется 2 моля [NH3], а из Х молей [H2] образуется 0,4 моля [NH3], откуда Х = Аналогично находим, что к моменту равновесия израсходовалось [N2]изр = Рассчитаем исходные концентрации веществ [N2]исх = [N2]равн + [N2]изр = 1,8 + 0,2 = 2,0 моль/л; [H2]исх = [H2]равн + [H2]изр = 7,4 + 0,6 = 8,0 моль/л. Для решения этой задачи удобно составить схему: N2(г) + 3H2(г) ⇄ 2 NH3 (г) Сисх 2,0 8,0 0 Сизр 0,2 0,6 0
Сравн 1,8 7,4 0,4 С помощью этой схемы можно сделать любые расчеты, учитывая условия задачи. б) Согласно условию, Т = 500 + 273 = 773К, V= 1л. Исходное число молей реагентов nнач = nнач [N2] + nнач[H2] = 2 + 8 = 10 молей. В состоянии равновесия число молей газов будет равно nравн = nравн [H2] + nравн[N2] + nравн [NH3] = 7,4 + 1,8 + 0,4 = 9,6 моль.
Подставляя полученные значения в уравнение ( P = CRT) рассчитаем давление газовой смеси в начальный момент и в момент равновесия (R=8,31Дж/моль∙К=0,082 л∙атм/моль∙град). Рнач = 10∙0,082∙773 = 633,86 атм Рравн = 9,6∙0,082∙773 = 608,5 атм Очевидно, что давление к моменту равновесия уменьшилось, т.к. реакция идет с убылью числа молей газов. Задача 4 При 250С для реакции 1) SO2(г) + 1/2O2(г) ⇄ SO3(г) Решение. Согласно закону действующих масс для реакции 1) выражение константы химического равновесия будет иметь вид:
Известно, что а) Кр = Кс (RT) Dn , где Dn = ånпрод. - ånисх.веществ –изменение числа молей газообразных веществ в ходе реакции. Для реакции 2) Dn = (2+1) – 2 =1. Подставляя в ур.а) Т= 298К, R=0,082 л∙атм/моль∙К, получим КС =
Задача 5 Для реакции CO(г) + Cl2(г) ⇄ COCl2(г) вычислить константу равновесия Кр, используя табличные значения термодинамических функций при стандартных условиях. По значению величины Кр ответить на вопрос: исходные вещества или продукты реакции преобладают в равновесной смеси? Решение. Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением DG0х.р. = - 2,303RT lgKp (1). В свою очередь, DG0х.р. (химической реакции) можно рассчитать по изменению стандартных величин энтальпии и энтропии в ходе этой реакции DG0х.р. = DН0х.р. - Т∙DS0х.р. ∙10-3 (2). Значения DН0х.р. и DS0х.р. вычисляют по первому следствию из закона Гесса, используя табличные значения стандартных энтальпий образования и энтропий веществ DН0х.р. = å(DН0298)кон - å(DН0298)исх и DS0х.р. = å(DS0298)кон - å(DS0298)исх. Значения DН0298 и S0298 веществ, участвующих в реакции приведены в таблице.
DН0х.р. = DН0298 (COCl2) - DН0298(Cl2) - DН0298(CO) = -220,3 – 0 – (-110,6) = -109,7кДж DS0хр= S0298(COCl2) - S0298(Cl2) - S0298(CO) = 283,9 – 222,9 – 197,7 = -136,7 Дж/К DG0хр = -109,7 – 298 ∙(-136,7)∙10-3 = -69,3 кДж Из уравнения (1) следует lgKp= Задача 6 При некоторой температуре константа равновесия реакции H2(г) + I2(г) ⇄ 2HI(г) равна 50. Рассчитать равновесные концентрации веществ, если исходные концентрации водорода и йода были соответственно 0,6 и 0,8 моль/л. Решение. Предположим, что к моменту равновесия прореагировало x молей водорода и, значит, х молей йода. Тогда их равновесные концентрации будут Подставляя в него соответствующие выражения, получим 50 = х1,2 = 0,76 ± 0,24, х1 = 1, х2 = 0,52. Первое значение не подходит по смыслу, т.к. уменьшение концентрации не может быть больше, чем исходные концентрации водорода и йода. Поэтому искомое значение х составляет 0,52моль/л. Следовательно, равновесные концентрации веществ будут равны: Задача 7 Для реакции CaCO3(тв) ⇄ CaO(тв) + CO2 (г) при 6000С и 7000С равновесные парциальные давления CO2 соответственно равны 0,0024 атм и 0,029 атм. Определить: 1) константы равновесия Решение. 1) Реакция термического разложения карбоната кальция является гетерогенным процессом. Выражение константы равновесия будет 2) Тепловой эффект при Р,Т = const равен изменению энтальпии химической реакции DН0х.р. Для расчета DН0х.р. можно воспользоваться следующим уравнением
DН0х.р. =
КОНТРОЛЬНЫЕ ЗАДАЧИ 1. Во сколько раз изменится скорость прямой реакции (реакцию считать элементарной) при изменении давления в n раз? а) 2C(тв) + H2(г) ⇄ C2H2(г) м) CO2(г)+ H2(г) ⇄ CO(г) + H2O(ж) б) 2CO(г) + O2(г) ⇄ 2CO2(г) н) N2(г) + O2(г) ⇄ 2NO(г) в) 2C(тв) + O2(г) ⇄ 2CO(г) o) H2(г) + I2(г) ⇄ 2HI(г) г) 2NO(г) + Cl2(г) ⇄ 2NOCl(г) п) 2NO(г) + O2(г) ⇄ 2NO2(г) д) CO(г) + H2O(г) ⇄ H2(г) + CO2(г) р) 2HI(г) ⇄ H2(г) + I2(г) е) C(тв) + 2H2(г) ⇄ CH4(г) c) C(тв) + O2(г) ⇄ CO2(г) ж) PCl5(г) ⇄ PCl3(г) + Cl2(г) т) COCl2(г) ⇄ CO(г) + Cl2(г) з)SO2Cl2(г) ⇄ SO2(г) + Cl2(г) у) 2SO2(г) + O2(г) ⇄ 2SO3(г) и) N2O4(г) ⇄ 2NO2(г) ф) H2(г) + 1/2O2(г) ⇄ H2O(г) к) 2CO2(г) ⇄ O2(г) +2CO(г) x) 2NO(г) + O2(г) ⇄ N2O4(г) л) CO(г) + MgO(тв) ⇄ CO2(г) + Mg(тв) 2.Во сколько раз надо увеличить давление в сосуде, чтобы скорость реакции H2(г) + I2(г) = 2HI(г) возросла в 100 раз? 3. Реакция идет по уравнению 2NO(г) + O2(г) ⇄ 2NO2(г) Начальные концентрации реагирующих веществ были [NO] = 0,8 моль/л; [O2] = 0,6 моль/л. Как изменится скорость реакции, если концентрацию кислорода увеличить до 0,9 моль/л, а концентрацию оксида азота до 1,2 моль/л (Т=const)? 4. Скорость реакции H2(г) + I2(г) ⇄ 2HI(г) при [H2] = 0,5моль/л и [I2] = 0,3 моль/л равна 0,018 моль/ л∙мин. Рассчитать константу скорости прямой реакции. 5. Скорость реакции 2NO(г) + O2(г) ⇄ 2NO2(г) при [NO] = 0,3моль/л; [O2] = 0,15 моль/л равна 1,2 ∙10-3 моль/л∙с. Рассчитать константу скорости. 6. Константа скорости реакции образования HI из простых веществ при 781К равна 0,16. Чему равна скорость реакции в начальный момент времени, когда:
а) [I2] = 0,05 моль/л; [H2] = 0,09 моль/л; [HI] = 0 моль/л б) когда успело образоваться 0,04 моль/л HI. 7. Константа скорости реакции 2NO(г) + O2(г) ⇄ N2O4(г) при некоторой температуре равна 0,5∙10-3 л2 /мол2∙с. Рассчитать скорость реакции: а) при [NO] = 0,8 моль/л, [O2] = 0,6 моль/л; [N2O4] = 0 моль/л б) через некоторый промежуток времени, за который прореагировало 0,2 моль/л кислорода. 8. Разложение N2O на поверхности золота при высоких температурах протекает по уравнению 2N2O(г) ⇄ 2N2(г) + O2(г). Константа скорости данной реакции равна 5∙10-4 л∙моль-1∙ мин-1 при 1173К. Начальная концентрация [N2O] = 3,2 моль/л. Определите скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложится 25% N2O. 9. Во сколько раз изменится скорость реакции при повышении температуры с 20 до 1000С, если g = 2? 10. Скорость некоторой реакции при охлаждении с 60 до 300С уменьшилась в 8 раз. Рассчитать g. 11. Рассчитать температурный коэффициент реакции, если ее скорость при 1200С составляла 5,88 ∙10-4 моль/л∙мин, а при 1700С она была равна 6,70∙10-2 моль/л∙мин. 12. При увеличении температуры на 600 скорость реакции возросла в 150 раз. Рассчитать температурный коэффициент. 13. При температуре 200С в результате некоторой реакции через 1час накопилось определенное количество продукта. При какой температуре следует вести процесс, чтобы тоже количество продукта накопилось за 10 минут? g = 2,4. 14. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. 15. Во сколько раз увеличится скорость растворения железа в 5%-ной HCl при повышении температуры на 32˚, если температурный коэффициент скорости растворения равен 2,8? 16. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45˚ реакция замедлилась в 25 раз. 17. Какой должна быть энергия активации, чтобы скорость реакции увеличилась в 3 раза при возрастании температуры от 300 до 310К? 18. Энергия активации процесса термического разложения йодистого водорода равна 198 кДж/моль. Какая доля молекул обладает достаточной энергией, чтобы вступить в эту реакцию при температуре 500К? 19. Определить энергию активации реакции С12Н22О11 + Н2О = 2С6Н12О6, если константа скорости при 210С равна 4,42∙10-4, а при 410С = 7,35∙10-3. 20. Для реакции COCl2(г) ⇄ CO(г) + Cl2(г) константы скорости при 665К и 745К соответственно равны 0,53∙10-2 и 76,6∙10-2. Вычислить энергию активации. 21. Константа скорости реакции H2(г) + I2(г) ⇄ 2HI(г) при 781К равна 0,16. Энергия активации процесса равна 166,3 кДж/моль. Рассчитать константу скорости этой реакции при 900К. Предэкспоненциальный множитель считать независящим от температуры. 22. Для реакции SO2(г) + 1/2 O2(г) ⇄ SO3(г) энергия активации равна 249,9 кДж/моль. В присутствии платинового катализатора энергия активации снижается до 62,4 кДж/моль. Во сколько раз изменится скорость реакции в присутствии катализатора при температуре 4000С. Предэкспоненциальный множитель считать независящим от температуры. 23.Энергия активации прямого процесса H2(г) + I2(г) ⇄ 2HI(г) равна 166,3кДж/моль, а для обратной реакции Еа = 182,9кДж/моль. Рассчитать DН0 химической реакции. 24. Во сколько раз увеличится скорость реакции, если при температуре 500К ее энергия активации, за счет введения в реакционную среду катализатора, уменьшится на а) 4 кДж/моль; б) 8кДж/моль; в) 12кДж/моль; г) 16кДж/моль; д) 20кДж/моль; е) 30кДж/моль; ж) 35кДж/моль; з) 40кДж/моль; и) 45кДж/моль. 25 25. Для следующих обратимых процессов: а) N2(г) + 3H2(г) ⇄ 2NH3(г) б) H2(г) + Cl2 (г) ⇄ 2HCl(г) в) N2O4(г) ⇄ 2NO2(г) г) CO(г) + H2O(г) ⇄ H2(г) + CO2(г) д) СН4(г)+ 2О2(г) ⇄ СО2(г) + 2Н2О(г) е) C(тв) + O2(г) ⇄ CO2(г) ж) CO(г) +NO2(г) ⇄ CO2(г) + NO(г) з) FeO(тв)+ CO(г) ⇄ Fe(тв)+ CO2(г) и) 2NO(г) + Cl2(г) ⇄ 2NОCl(г) к) COCl2(г) ⇄ CO(г) + Cl2(г) л) 4HCl(г) + О2(г) ⇄ 2H2O(г) + 2Cl2(г) м) 2C(тв) + O2(г) ⇄ 2CO(г) н)3CO(г) + 2H2O(г) ⇄ СH3ОН(г) + 2CO2(г ) о) SO2(г) ⇄ S(ромб) +О2(г) п) CO(г) + Cl2(г) ⇄ COCl 2(г) р) CO(г) + 3H2(г) ⇄ H2О(г) + CН4(г) с) Fe2O3(тв)+3H2(г) ⇄ 2Fe(тв)+ 3H2O(г) т) 2C(тв) + H2(г) ⇄ C2H2(г) 1) Записать математические выражения констант равновесия Кс и Кр; 2) Вычислить соотношение между Кс и Кр при 250С; 3) Используя таблицы термодинамических величин найти значение Кр. 26. Для реакции N2O4(г) ⇄ 2NO2(г) Кр = 0,141 при 250С и Кр = 1,34 при 600С. На основании этих данных определить знак DН реакции. (DН>0 или DН<0). 27. Для реакции SO2(г) + 1/2O2(г) ⇄ SO3(г) Кр = 2,043∙10-2 при 9000С и Кр = 1,062∙10-2 при 9500С. На основании этих данных определить знак DН реакции. (DН>0 или DН<0). 28. По данным значениям констант равновесия найти значения DG0 химических реакций.
29. Для реакции N2(г) + O2(г) ⇄ 2NO(г) Кр = 4,08∙10-4 при 2000К и Кр=3,60∙10-3 при 2500К. На основании этих данных определить знак DН реакции. (DН>0 или DН<0). 30. Для реакции Н2(г) ⇄ 2Н(г) Кр = 1,52∙10-7 при 1800К и Кр = 3,10∙10-6 при 2000К. На основании этих данных определить знак DН реакции. (DН>0 или DН<0). 31. Константа равновесия Кр реакции 2SO2(г) + O2(г) ⇄ 2SO3(г) при 950К равна 1,062∙10-2 . Вычислите Кс для этой реакции. 32. При 873К константа равновесия Кс реакции CO(г) + Cl2(г) ⇄ COCl2(г) равна 12,12. Вычислите Кр реакции при этой температуре. 33. DG0298 образования NH3 равна -16,64 кДж/моль. Вычислите Кр реакции N2(г) + 3H2(г) ⇄ 2NH3(г) для данной температуры. 34. Реакция хлорирования монооксида углерода протекает по схеме: CO(г) + Cl2(г) ⇄ COCl2(г). Исходные концентрации СО и Cl2 были, соответственно, 0,5 и 0,2 моль/л. Вычислить концентрации всех веществ в момент времени, когда концентрация хлора стала 0,1 моль/л. 35. Концентрации веществ в реакции CO(г) + H2O(г) ⇄ H2(г) + CO2(г) составляли: [CO] = 0,2 моль/л, [H2O] = 0,4 моль/л, [CO2] = 0,3 моль/л, [H2] = 0,1 моль/л. Вычислить концентрации всех веществ в момент, когда прореагировало 40% СО. 36. Исходные концентрации монооксида азота и хлора в системе 2NO(г) + Cl2(г) ⇄ 2NОCl(г) составляют соответственно 0,4моль/л и 0,3моль/л. Вычислить Кс, если при этой температуре к моменту равновесия прореагировало 20% NO. Рассчитать, как при этом изменится давление в реакционном сосуде? 37. Рассчитать константу равновесия Кс реакции N2O4 (г) ⇄ 2NO2(г), если исходная концентрация N2O4 равна 0,02 моль/л и к моменту равновесия прореагировало 60% этого количества. 38. Иодистый водород при нагревании диссоциирует по уравнению 2HI (г) ⇄ H2(г) + I2(г) . При некоторой температуре Кс = 1,64. Рассчитать количество HI (в процентах), подвергшееся диссоциации при данной температуре, если его исходная концентрация составляла 4 моль/л. 39. Константа равновесия реакции H2(г) + I2(г) ⇄ 2HI(г) при некоторой температуре равна 50. Сколько молей йодистого водорода получится, если нагреть до этой температуры в замкнутом сосуде объемом 1л 0,5 молей водорода и 1 моль иода? 40. При температуре 4940С в системе 2NO(г) + O2(г) ⇄ 2NO2(г) в момент равновесия концентрация кислорода стала 0,1 моль/л, а концентрация двуокиси азота – 0,25 моль/л. Определить исходную концентрацию монооксида азота, если для данной температуры Кс = 2,2. 41. При нагревании смеси CO2 и H2 в закрытом сосуде установилось равновесие CO2 (г)+ H2 (г) ⇄ CO(г) + H2O(г). При Т= 1123К Кс = 1. Сколько молей диоксида углерода надо взять на 1 моль водорода, чтобы 70% последнего превратилось в воду? 42. Вычислить степень диссоциации (a) молекулярного хлора на атомы Cl2(г) ⇄ 2Cl(г), если Кс = 4,2∙10-4 , а исходная концентрация молекулярного хлора составляла 0,5 моль/л. 43. При 2500С для процесса PCl5 (г) ⇄ PCl3(г) + Cl2(г) Кс = 0,041. Сколько молей PCl5 при этой температуре было помещено в литровый сосуд, если в момент равновесия концентрация хлора была 0,1 моль/л. 44. Константа равновесия реакции H2(г) + I2(г) ⇄ 2HI (г) при 4450С равна 50. Сколько молей Н2 надо взять на 1 моль I2, чтобы 90% иода превратилось в HI? 45. Общее давление газов в системе 1 атм. Определить объемный процент содержания монооксида углерода в момент равновесия для реакции FeO(тв) + CO(г) ⇄ Fe(тв) + CO2(г), если при Т=1273К Кр= 0,4. 46.Исходные концентрации азота и водорода в системе: N2 (г) + 3H2 (г) ⇄ 2NH3(г) были [N2] = 2 моль/л, [H2]= 8 моль/л. К моменту наступления равновесия прореагировало 10% исходного количества азота. Вычислить давление газовой смеси в момент равновесия при 5000С. 47. При 630С Кр= 1,27 для реакции N2O4 (г) ⇄ 2NO2(г). Определить равновесные парциальные давления газов, если общее давление в состоянии равновесия было 1атм. 48. Как изменится давление к моменту наступления равновесия в системе N2O4(г) ⇄ 2NO2(г) при постоянной температуре, если исходная концентрация N2O4 составляла 2 моль/л, и к моменту наступления состояния равновесия прореагировало 25% от первоначального его количества? 49. При каком общем давлении должна находиться равновесная система PCl5(г) ⇄ PCl3(г) + Cl2(г), чтобы парциальное давление PCl5 при 250оС было равно 1атм. Кр = 1,78. 50. Для реакции C(гр) + 2H2(г) ⇄ CH4(г) Кс = 21,85 при 1000К. Рассчитать общее давление в состоянии равновесия, когда при Т = 1000К в сосуде емкостью 1л образовалось 0,1 моль метана. 51. Вычислить равновесные концентрации веществ в обратимой химической реакции CO(г) + H2O(г) ⇄ H2(г) + CO2(г), для которой Кс=1(Т=8500С), если исходные концентрации веществ составляли: [CO] = 2 моль/л, [H2O]=3 моль/л. 52. Вычислить константы равновесия (Кр) реакций: а) C(гр) + O2(г) ⇄ CO2(г); б) C(гр) + СO2(г) ⇄ 2CO(г), в которых парциальные давления СО2 в момент равновесия составляют 0,2 атм, а общее давление газов =1 атм. (для каждого случая отдельно). 53.В начальный момент протекания реакции N2 (г) + 3H2 (г) ⇄ 2 NH3 (г) концентрации были равны: [N2] =1,5 моль/л; [H2] = 2,5 моль/л; [NH3] = 0 моль/л. Каковы концентрации азота и водорода при [NH3] = 0,5 моль/л? 54. Концентрации веществ в реакции CO(г) + H2O(г) ⇄ H2(г) + CO2(г) были: [CO] = 0,05 моль/л; [H2O] = 0,06 моль/л; [H2] = 0,2 моль/л; [CO2] = 0,4 моль/л. Вычислите концентрации всех участвующих в реакции веществ после того, как прореагировало 60% H2O. 55. Реакция протекает по уравнению 4HCl(г) + О2(г) ⇄ 2H2O(г) + 2Cl2(г). Через некоторое время после начала реакции концентрации участвующих в ней веществ стали [HCl] = 0,85 моль/л; [O2] = 0,44 моль/л; [Cl2] = 0,30 моль/л. Какими были концентрации HCl и O2 в начале реакции? 56. Константа равновесия реакции N2(г) + 3H2(г) ⇄ 2 NH3(г) Кс=0,1 при 673К. Равновесные концентрации [H2] = 0,6 моль/л; [NH3] = 0,18 моль/л. Вычислить начальную и равновесную концентрации азота. 57. Равновесные концентрации участников реакции CO(г) + H2O (г) ⇄ H2 (г) + CO2 (г) были: [CO] = 0,02 моль/л; [H2O] = 0,32 моль/л; [H2] = 0,08 моль/л; [CO2] = 0,08 моль/л. Какими станут равновесные концентрации всех компонентов после сдвига равновесия, вызванного увеличением концентрации СО в 2 раза? 58. Имеется система, в которой протекает реакция Ag2O (тв) ⇄ 2Ag(тв) + 1/2O2(г) DН0298 = 32,2 кДж. Как скажется на концентрации кислорода над поверхностью твердой фазы: а) введение дополнительного количества Ag2O; б) повышение температуры? 59. Для реакции 3Fe(тв) + 4H2O(г) ⇄ Fe3O4(тв) + 4H2(г) DН0298 = -148,4кДж. Указать, как будет сказываться на концентрации водорода в равновесной смеси: а) повышение температуры; б) увеличение общего давления; в) увеличение весового количества железа; г) введение дополнительного количества водяного пара; д) как соотносятся энергии активации прямого и обратного процесса? 60. Дана обратимая реакция: 4HCl(г) + O2(г) ⇄ 2H2O(г) + 2Cl2(г) DН0298= -112,24 кДж. Как повлияют на равновесную концентрацию хлора следующие изменения: а) повышение температуры; б) увеличение общего давления; в) увеличение концентрации кислорода; г) увеличение объема реакционного сосуда; д) введение катализатора. 61. Для реакции CaCO3(тв) ⇄ CaO(тв) + CO2(г) DН0298=176,04 кДж. Указать, как повлияют на равновесную концентрацию диоксида углерода следующие изменения: а) понижение температуры; б) увеличение весового количества карбоната кальция; г) введение катализатора; д) измельчение имеющегося количества карбоната кальция? 62. Для обратимой реакции SO2(г) + 1/2O2(г) ⇄ SO3(г) DН0298 = -95,6 кДж ответить на вопросы: а) что можно сказать о соотношении энергий активации прямого и обратного процессов; б) как скажется на концентрации диоксида серы введение дополнительного количества кислорода; в) изменится ли концентрация триоксида серы при увеличении общего давления (Т=const); г) как изменится концентрация
кислорода при повышении температуры; д) куда сместится равновесие при увеличении объема реакционного сосуда; е) скажется ли на равновесной концентрации триоксида серы введение в реакционную смесь катализатора? 63. В каком направлении сместится равновесие при увеличении общего давления и почему? а) H2(г) + I2(г) ⇄ 2HI(г); б) N2(г) + 3H2(г) ⇄ 2NH3(г); в) N2O4(г) ⇄ 2NO2(г); г) 2C(гр) + H2(г) ⇄ C2H2(г). 64. В каком направлении сместится равновесие при понижении температуры и почему? а) SO2(г)+1/2O2(г) ⇄ SO3(г) DН0298 = -95кДж; б) C(гр) + O2(г) ⇄ CO2(г) DН0298 = -393,8кДж; в) N2(г)+3H2(г) ⇄ 2NH3(г) DН0298 = -92кДж; г) CaCO3(тв) ⇄ CaO(тв)+CO2(г) DН0298 = 176кДж 65. Для следующих реакций рассчитать DН0х.р. и определить, в каком направлении сместится равновесие при повышении температуры? a) CaCO3(тв) ⇄ CaO(тв) + CO2(г); б) 2Mg(тв) + O2(г) ⇄ 2MgO(тв); в) O2(г) + N2(г) ⇄ 2NO(г); г) N2(г) + 3H2(г) ⇄ 2NH3(г); д) N2O4(г) ⇄ 2NO2(г) 66. При каких условиях надо вести реакцию N2 (г) + 3H2 (г) ⇄ 2NH3 (г), DН0298= -92,3кДж, чтобы получить максимальный выход аммиака? Как объяснить, что на практике синтез аммиака ведут при высокой температуре (400-5000С)? 67.Используя табличные данные, рассчитать DН0298 , и с учетом знака (DН0298)хр определить, как отразится на положении равновесия повышение температуры. В каком направлении сместится равновесие, если при Т=const увеличить внешнее давление? а) 2SO2(г) + O2(г) ⇄ 2SO3(г) б) H2S(г) ⇄ H2(г) + Sромб. в) H2(г) + Br2(г) ⇄ 2HBr(г) г) C(графит) + 2H2(г) ⇄ CH4(г) д) C2 H4(г) ⇄ C2 H2(г) + H2(г) е) 2C(гр) + H2(г) ⇄ C2H2(г) ж) CO(г) + Cl2(г) ⇄ COCl2(г) з) Fe2O3(тв) + 3CO(г) ⇄ 2Fe(тв) + 3CO2(г) и) Fe3O4(тв)+4H2(г) ⇄ 3Fe(тв)+ 4H2O(г) к) CН4(г) + H2О(г) ⇄ CО(г) + 3H2(г) л) 2HBr(г) + Cl2 (г) ⇄ 2HCl(г) + Br2(ж) 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
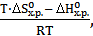 lnKp =
lnKp = 
 =
=  [SO2]2[O2]. После повышения давления в 3 раза концентрация всех газовых компонентов возрастет также в 3 раза, при этом константа скорости реакции останется неизменной, т.к. она не зависит от концентрации реагирующих веществ.
[SO2]2[O2]. После повышения давления в 3 раза концентрация всех газовых компонентов возрастет также в 3 раза, при этом константа скорости реакции останется неизменной, т.к. она не зависит от концентрации реагирующих веществ. =
= 

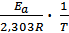 + lgA0. Запишем это уравнение для двух температур lgk1 =
+ lgA0. Запишем это уравнение для двух температур lgk1 = 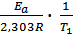 + lgA0 ; lgk2 =
+ lgA0 ; lgk2 = 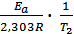 + lgA0 . Вычитая из второго уравнения первое и решая относительно энергии активации, получим Ea =
+ lgA0 . Вычитая из второго уравнения первое и решая относительно энергии активации, получим Ea = 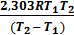 lg
lg  . Подставляя численные значения величин в это уравнение, получим
. Подставляя численные значения величин в это уравнение, получим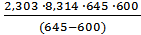 lg
lg  = 113,2 кДж/моль.
= 113,2 кДж/моль. = 0,6 моля = [H2]изр.
= 0,6 моля = [H2]изр.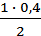 = 0,2 моля.
= 0,2 моля. = 1,7∙1012. Рассчитать Кр и Кс при этой температуре для реакции 2) 2SO3(г) ⇄ 2SO2(г) + O2(г)
= 1,7∙1012. Рассчитать Кр и Кс при этой температуре для реакции 2) 2SO3(г) ⇄ 2SO2(г) + O2(г)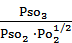 , а для реакции 2)
, а для реакции 2) 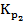 =
= 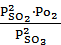 . Нетрудно получить, что между
. Нетрудно получить, что между  . Подставляя численные значения, получим:
. Подставляя численные значения, получим:  = 0,345∙10-24.
= 0,345∙10-24. = 1,4∙10-26.
= 1,4∙10-26.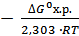 = -
= - 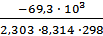 = 12,13 Кр= 1012,13, т.к. Кр>>1, то при Т=298К в равновесной смеси будут преобладать продукты реакции.
= 12,13 Кр= 1012,13, т.к. Кр>>1, то при Т=298К в равновесной смеси будут преобладать продукты реакции.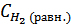 = 0,6 - х моль/л ,
= 0,6 - х моль/л ,  )= 0,8 - х моль/л, а равновесная концентрация йодистого водорода составит
)= 0,8 - х моль/л, а равновесная концентрация йодистого водорода составит 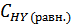 = 2х моль/л. Выражение константы равновесия для этой реакции будет КС =
= 2х моль/л. Выражение константы равновесия для этой реакции будет КС = 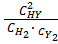 .
.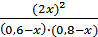 , откуда х2 - 1,52х + 0,52 = 0,
, откуда х2 - 1,52х + 0,52 = 0,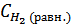 = 0,6 - 0,52 = 0,08 моль/л,
= 0,6 - 0,52 = 0,08 моль/л, 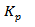 для данных температур; 2) тепловой эффект реакции при Р = const, считая его постоянным для интервала температур 600-7000С.
для данных температур; 2) тепловой эффект реакции при Р = const, считая его постоянным для интервала температур 600-7000С. =
= 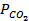 . Следовательно, при указанных температурах константы равновесия будут иметь следующие значения
. Следовательно, при указанных температурах константы равновесия будут иметь следующие значения 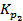 = 0,029.
= 0,029.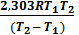 lg
lg 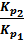 =
= 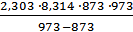 lg
lg  = 176,65 кДж.
= 176,65 кДж.