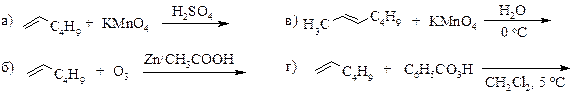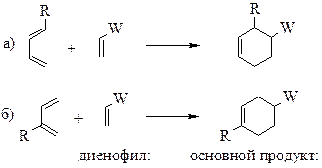|
|
Названия заместителей в префиксах и суффиксахПРЕДИСЛОВИЕ
«Органическая химия» – одна из базовых дисциплин, изучаемых на биологическом факультете университета. На современном этапе уровень развития органической химии как науки определяет развитие таких смежных дисциплин, как биохимия, молекулярная биология, химическая биология и др. Очевидно, что успешное усвоение студентами-биологами органической химии является важным фактором в их формировании как современных специалистов, способных решать проблемы биологической науки. В пособии представлены задачи, различные по сложности, при решении которых студент должен применить теоретические знания по органической химии, почерпнутые на лекции или из учебников. Регулярное выполнение домашних заданий позволяет систематизировать и углубить эти знания.
СОДЕРЖАНИЕ 1. номенклатура органических соединений.............................................................. 3 2. АЛКАНЫ.................................................................................................................. 9 3. ЦИКЛОАЛКАНЫ.................................................................................................. 14 4. АЛКЕНЫ................................................................................................................. 16 5. АЛКАДИЕНЫ........................................................................................................ 24 6. АЛКИНЫ................................................................................................................ 30 7. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ................................................................. 34 8. ГАЛОГЕНУГЛЕВОДОРОДЫ.............................................................................. 41 9. СПИРТЫ, ФЕНОЛЫ, ПРОСТЫЕ ЭФИРЫ......................................................... 54 10. АМИНЫ.................................................................................................................. 63 11. 11. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ.............................................................. 70 12. 12. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ................................. 78 13. 13. ОТВЕТЫ............................................................................................................ 84 14. 14. Приложения...................................................................................................... 89 15. 15. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА............................................................. 99 1. номенклатура органических соединений
При составлении систематических названий органических соединений IUPAC рекомендует использовать заместительный принцип. Терминология: · родоначальная структура (родовой гидрид) – основа названия органического соединения. Может быть линейным алканом, карбо- или гетероциклом; · функциональные (или характеристические) группы – группы атомов, включающие гетероатомы, которые обусловливают наличие у данных представителей органических соединений специфических, лишь им присущих свойств. Именно природа функциональной группы лежит в основе деления органических веществ на классы. Характеристические группы называют в префиксе (перед родовым гидридом) или в суффиксе (после родового гидрида). Когда в молекуле присутствуют несколько функциональных групп, то только одну называют в суффиксе (главная группа). Для выявления главной группы пользуются порядком приоритетности. Некоторые группы называют только в префиксе (см. табл. 1 и 2 приложения). В некоторых случаях IUPAC разрешает использовать тривиальные названия (см. табл. 3 и 4 приложения).
Принципы номенклатуры органических соединений
1.1. Назовите родоначальный углеводород (родовой гидрид) для представленных соединений.
1.2. Назовите следующее соединение по систематической номенклатуре.
1.3. В каждом из соединений определите родоначальную структуру (родовой гидрид), отметьте и назовите функциональные группы, укажите, какая из них главная, составьте названия по систематической номенклатуре.
1.4. В каждом из соединений отметьте главную группу и назовите соединения по систематической номенклатуре.
Стереоизомерия, хиральность
1.5. Дайте определения понятиям «конформация» и «конфигурация» молекулы.
1.6. Дайте определение понятиям «асимметрический атом», «стереоцентр», «оптическая активность», «хиральная молекула», «ахиральная молекула».
1.7. Дайте определение понятиям «энантиомер», «диастереомер», «рацемическая смесь». 1.8. Отметьте стереоцентры в молекулах следующих соединений.
1.9.Изобразите структурные формулы следующих соединений. Отметьте стереоцентры.
1.10.Изобразите структурные формулы самых простых хиральных соединений ряда:
1.11. Какие из этих соединений могут существовать в виде энантиомеров? Изобразите их структурные формулы.
1.12. Приведите формулы всех структурных изомеров с молекулярной формулой C4H8O, укажите, для каких из них возможна пространственная изомерия, изобразите стереохимические формулы пространственных изомеров.
1.13.Какие из указанных алкенов могут существовать в виде p‑диастереомеров? Назовите эти изомеры по E,Z-номенклатуре.
Номенклатура стереоизомеров, абсолютная и относительная конфигурация
1.14. Расположите атомы и группы атомов каждой серии в порядке убывания старшинства согласно правилам Канна–Ингольда–Прелога.
1.15.* Определите абсолютную конфигурацию стереоцентров следующих соединений:
1.16. Определите абсолютную конфигурацию стереоцентров следующих соединений:
1.17. Изобразите в виде перспективных формул и формул Фишера следующие соединения:
1.18. Изобразите проекционную формулу Фишера (S)-2-бутанола. Как изменится конфигурация стереоцентра изображенного соединения при: а) перемене мест двух групп относительно вертикальной линии связей; б) перемене мест двух групп относительно горизонтальной линии связей; в) последовательном действии (а) и (б); г) перемене мест «вертикального» и «горизонтального» заместителей; д) повороте в плоскости бумаги на 90°; е) повороте на 180° в плоскости, перпендикулярной плоскости бумаги?
1.19. Определите абсолютную конфигурацию стереоцентров следующих соединений. Изобразите данные соединения в виде перспективных формул. Отнесите аминокислоту в пункте (г) к D- или L‑ряду.
1.20. Изобразите формулы всех стереоизомеров 3-хлорпентан-2-ола. В каких стереохимических отношениях друг к другу находятся эти стереоизомеры?
1.21.* Определите абсолютную и относительную (где возможно) конфигурацию стереоцентров в следующих соединениях. Изобразите эти соединения в виде перспективных формул.
1.22.Изобразите проекционные формулы Ньюмена и Фишера следующего соединения. Укажите его конфигурацию по трео/эритро- и по R/S-номенклатурам. Изобразите энантиомер этого соединения.
1.23. Для каждого из приведенных ниже соединений укажите возможное число стереоизомеров. Изобразите их, найдите энантиомеры, диастереомеры, мезо-формы. Какова структурная особенность мезо‑соединений? Определите R/S-конфигурацию всех стереоизомеров. а) 2,3-бутандиол, б) 5-хлоргепт-2-ен, в) 1,2-дибром-1,2-диметилциклогексан.
Оптическая активность
1.24.* Удельное оптическое вращение [a] связано с наблюдаемым оптическим вращением aнабл формулой: aнабл = [a]lc, где a – угол в градусах, l – длина кюветы, дм; с – концентрация раствора, г/мл. Определите удельное вращение кониина, токсического компонента болиголова, если раствор, содержащий 0.75 г/10 мл и помещенный в кювету поляриметра длиной 1 дм, показывает вращение при 25 °С (D линия Na, 589 нм) +1.2°. Каково удельное вращение энантиомера кониина?
1.25.* Определите, какое вращение покажет раствор кониина (см. 1.24.) с концентрацией 0.35 г/мл, помещенный в кювету поляриметра длиной 5 см (D линия Na, 589 нм). Каково будет значение наблюдаемого вращения, если: а) концентрацию увеличить в 2 раза, б) длину трубки увеличить в 2 раза? Как изменится в этих условиях удельное вращение?
1.26.* Рассчитайте концентрацию раствора кониина (см. 1.24.), показывающего вращение +2.0° в трубке длиной 1 дм (D линия Na, 589 нм).
1.27. Вещество, в молекуле которого имеются асимметрические атомы, показывает нулевое вращение в определенном растворителе. Значит ли это, что данное соединение не является хиральным?
1.28. Какова оптическая чистота (ОЧ) образца соединения, выделенного из реакционной смеси и имеющего aнабл = +6.0°, если [a]D = +12°? Рассчитайте процентный состав (мольн. %) полученной смеси стереоизомеров.
2. АЛКАНЫ
Названия разветвленных алканов строятся на основе названий линейных алканов. Для изомерных алканов с числом атомов углерода 4 и 5 используются префиксы «изо» и «нео». Для их обозначения используют префиксы «н», «втор», «изо», «трет» (см. табл. 4 и 5 приложения). Молекулы алканов состоят из атомов углерода и водорода, связанных одинарной связью (σ-связью). Электроотрицательности углерода и водорода различаются на 0.4 условной единицы, что характеризует связь С–Н как малополярную. Химические превращения алканов включают, главным образом, радикальные реакции, в ходе которых разрыв связей происходит гомолитически. Образование из молекул алканов свободных радикалов энергетически выгоднее образования заряженных частиц – катионов и анионов. Так, гомолитический разрыв связи С–Н в молекуле метана требует 435 Кдж/моль, в то время как для образования пары ионов – карбокатиона сн3+ и гидрид-иона Н– необходимо 878 Кдж/моль. Превращение метана в метильный анион и протон энергетически еще невыгоднее. Для гомолитического разрыва связи С–С необходимо затратить 351 Кдж/моль, тогда как ее гетеролиз требует 757 Кдж/моль. Свободнорадикальные реакции алканов подробно изучены и, согласно исследованиям русского химика Н. Н. Семенова, протекают по цепному механизму. Примеры характерных радикально-цепных реакций алканов – реакции галогенирования, полного окисления (горения), каталитического окисления, пиролиза и крекинга, нитрования, сульфогалогенирования, сульфоокисления. В результате действия свободнорадикального реагента на молекулу алкана может происходить либо замещение одного или нескольких атомов водорода, либо разрыв углерод-углеродной связи. Хотя для разрыва С–С связи требуется затратить меньше энергии, чем для разрыва связи связи С–Н, реакции, приводящие к разрушению углеродного скелета алканов, протекают в более жестких условиях, чем реакции радикального замещения атома водорода. Это несоответствие объясняется пространственными затруднениями для доступа реагента к углерод-углеродной связи, которая «заслонена» атомами водорода, а также энергетическими эффектами соответствующих возможных реакций. Вследствие неравной стабильности промежуточно образующихся алкильных радикалов относительные скорости замещения атомов водорода при первичном, вторичном и третичном атомах углерода различны. Так, при хлорировании скорости замещения у первичного, вторичного и третичного С-атомов соотносятся как 1 : 3.8 : 5.0. При бромировании относительные скорости различаются сильнее – 1 : 82 : 1600. Таким образом, в реакциях радикального замещения в ряду алканов радикальный реагент «х•» в первую очередь атакует атом водорода у третичного атома углерода:
Наряду со свободнорадикальными реакциями алканов известны немногочисленные реакции, протекающие по ионному механизму. Промежуточное образование положительно заряженных частиц – карбениевых ионов происходит, например, в процессах скелетных перегруппировок алканов под действием кислотных реагентов. Такие перегруппировки протекают при проведении каталитического крекинга нефтепродуктов.
Строение, номенклатура
2.1.* Приведите названия по заместительной номенклатуре для этих соединений:
2.2.Изобразите структурные формулы следующих соединений. Для соединения (д) укажите количество первичных, вторичных и третичных атомов углерода:
2.3. Изобразите структурные формулы соединений и назовите их по систематической номенклатуре:
2.4. Изобразите структурные формулы всех изомерных алканов состава С7Н16. Дайте им названия по систематической номенклатуре. Укажите в них первичные, вторичные и третичные атомы углерода.
2.5. Углеводороды гептакозан (С27Н56) и гентриаконтан (С31Н64) обнаружены в пчелином воске. Каково строение углеродных цепей в молекулах этих углеводородов, если в них отсутствуют третичные и четвертичные атомы углерода?
2.6. Триптан (С7Н16) – алкан с наивысшим октановым числом (130). Изобразите структурную формулу триптана, если известно, что в его молекуле присутствует один третичный и один четвертичный атом углерода.
Химические свойства
2.7. Рассмотрите с общих позиций химические свойства алканов. Укажите главную причину химической инертности алканов по отношению к большинству реагентов при нормальных условиях. Назовите главный тип реакций, характерный для этих углеводородов. Каковы оптимальные условия их бромирования? Сколько можно получить изомерных продуктов монобромирования гексана и монохлорирования 2,2,3-триметилбутана? Какие С–Н связи в молекуле 2,2,3-триметилбутана наиболее реакционноспособны? Ответ поясните.
2.8. Напишите структурные формулы монохлорпроизводных, образующихся при действии хлора на изопентан при освещении УФ‑светом. Назовите их. Какие из них могут существовать в виде энантиомеров? Изобразите пространственную формулу для R-изомера любого из них.
2.9. Как объяснить тот факт, что относительная реакционная способность С–Н связей у первичного, вторичного и третичного углеродного атомов в изопентане в реакциях фотохимического хлорирования при –50 оС выражается соотношением 1 : 7 : 12, а при +50 оС соотношение меняется на 1 : 3 : 4?
2.10. Расположите в ряд по увеличению устойчивости следующие свободные радикалы:
2.11.* Рассчитайте содержание 2-галогенбутанов в смесях, образующихся при: а) монохлорировании и б) монобромировании бутана под действием УФ-света (принимая относительную реакционную способность С–Н связей у первичного, вторичного и третичного углеродного атомов в реакции хлорирования как соотношениее 1 : 3.8 : 5, а в реакции бромирования – 1 : 82 : 1600).
2.12. Изооктан – стандарт моторного топлива с октановым числом 100. Сколько различных продуктов монохлорирования можно получить из изооктана? Напишите структуру наиболее устойчивого промежуточного алкильного радикала, образующегося при проведении этой реакции.
2.13. Расположите в порядке увеличения устойчивости радикалы, образующиеся при монобромировании 3-метилпентана. Ответ поясните. Рассчитайте соотношение изомерных продуктов в этой реакции, если известно, что скорости замещения у первичного, вторичного и третичного атомов углерода в этой реакции соотносятся как 1 : 82 : 1600.
2.14. Рассчитайте соотношение скоростей замещения у первичного, вторичного и третичного углеродного атома в реакции монохлорирования изопентана при 300 оС, если известно, что соотношение изомеров в образующейся смеси составляет: первичные хлориды : вторичный хлорид : третичный хлорид – 0.45 : 0.33 : 0.22.
2.15. Приведите формулы всех изомерных продуктов сульфохлорирования пентана. Для одного из изомеров рассмотрите механизм его образования.
2.16. Напишите продукты реакций:
Установление структуры
2.17.* При монохлорировании соединения C13H28 возможно образование только двух изомерных продуктов. Установите структуру углеводорода.
2.18.* Вещество А при сплавлении со щелочью дает вещество Б, монобромирование которого на свету приводит к образованию практически одного изомера (содержание 99.4 %). Электролиз вещества А приводит к образованию вещества В состава С8Н18, при монохлорировании которого в аналогичных условиях образуется смесь первичного, вторичного и третичного монохлорпроизводных. Определите структуры соединений А, Б, В. Напишите уравнения описанных реакций.
2.19. Углеводород С5Н12 в условиях реакции Коновалова превращается в третичное нитропроизводное. Каково строение углеводорода?
2.20.* В спектре ПМР углеводорода С9Н20 имеются два синглета с d 0.98 и 1.26 м.д. и соотношением интенсивностей 9 : 1. Установите строение углеводорода. Сколько изомерных монохлорпроизводных он образует? 3. ЦИКЛОАЛКАНЫ
Химические свойства насыщенных циклических углеводородов с числом атомов углерода в цикле более четырех во многом сходны со свойствами алканов. Наиболее характерный тип превращений для них – гомолитические процессы – реакции радикального замещения атома водорода. Для этих циклоалканов известны также реакции каталитического дегидрирования. Так, при пропускании циклогексана через никелевый или платиновый катализатор при 200 °С происходит его дегидрирование и превращение в ароматическую систему – бензол. Химия малых циклов, к которым относятся циклопропан и циклобутан, более разнообразна. В силу особенности электронного строения циклопропан в реакциях проявляет двойственную природу. В зависимости от условий он способен вступать в характерные для алканов реакции радикального замещения атома водорода, а также, как это характерно для алкенов, в реакции присоединения с раскрытием трехуглеродного цикла. Легко протекают процессы присоединения к циклопропану водорода, галогенов, галогеноводородов. Циклобутан менее активен в реакциях присоединения, чем циклопропан, хотя и для него известны реакции раскрытия цикла, например, гидрирование. Реакции каталитического гидрирования циклопентана и циклогексана с образованием открытоцепных алканов требуют более жестких условий.
Строение, номенклатура
3.1.* Назовите по систематической номенклатуре следующие соединения. Для соединений г, д, з определите конфигурации стереоцентров; для соединения в определите относительную конфигурацию по эритро/трео-номенклатуре.
3.2. Напишите структурные формулы всех циклических изомеров С5Н10. Назовите их. Отметьте структурные и пространственные изомеры. Какие из них будут проявлять оптическую активность?
3.3. Изобразите стереохимические формулы всех стереоизомеров 1,2‑диметилциклопропана, 1,2‑диметилциклобутана и 1,3‑диметил-циклобутана; укажите их R/S-конфигурацию. Какие из них оптически активны?
3.4. Изобразите стереохимические формулы всех стереоизомеров 1,2‑ и 1,3-дихлорциклопентана. Определите их R/S-конфигурацию.
3.5.*Используя конформации «кресло», обсудите стереохимию цис- и транс-изомеров 1,2-, 1,3- и 1,4-диметилциклогексанов. Для каждого изомера выберите наиболее устойчивую конформацию.
3.6.* Изобразите наиболее устойчивую конформацию цис‑4‑третбутилциклогексанола.
3.7. Используя конформации «кресло», рассмотрите строение цис- и транс-декалинов.
Химические свойства
3.8. Сравните поведение циклопропана, циклобутана и циклопентана в реакции гидрирования. Напишите схемы реакций, ответ поясните.
3.9. Сравните отношение циклопропана и циклогексана к действию бромоводорода. Ответ поясните.
3.10. Предскажите продукты следующих реакций:
4. АЛКЕНЫ Названия некоторых алкенильных групп приводится в табл. 4 приложения. Наличие двойной углерод-углеродной связи в молекулах алкенов расширяет спектр их химических превращений по сравнению с насыщенными углеводородами. В зависимости от условий процесса и природы атакующего реагента алкены вступают в реакции, сопровождающиеся гомолитическим и гетеролитическим разрывом p‑связи; для алкенов также характерны перициклические реакции (циклоприсоединения). Электроны π-связи алкенов доступны для атаки электрофильных и свободнорадикальных агентов. Наиболее важная группа реакций алкенов – реакции электрофильного присоединения (AE). Как правило, такие реакции протекают региоселективно, и направление электрофильной атаки определяется относительной устойчивостью одного из двух карбокатионов, образование которых возможно в результате присоединения электрофила. Например:
Тот же принцип соблюдается и в реакциях радикального (AR) и нуклеофильного (AN) присоединения к алкенам. Некоторые реакции электрофильного присоединения протекают стереоселективно, важнейшая из них – транс-присоединение галогенов, в результате чего из двух возможных диастереомерных продуктов (в зависимости от конфигурации двойной связи в алкене это может быть эритро- или трео-изомер) образуется только один (в виде пары энантиомеров), например:
Процессы электрофильного присоединения к алкенам могут сопровождаться внутримолекулярными перегруппировками с миграцией атома водорода или алкильных групп, направление которых определяется образованием термодинамически более стабильных (как правило, третичных) карбокатионов:
В условиях радикальных реакций алкены могут реагировать по аллильному положению. Эти реакции проходят по механизму радикального замещения (SR) атома водорода в α-положении к двойной связи. Легкость образования аллильного радикала в этих реакциях обусловлена его мезомерной стабилизацией. Примеры аллильных реакций алкенов – высокотемпературное хлорирование алкенов хлором при 500 °C или аллильное бромирование N-бромсукцинимидом. Наличие по соседству с двойной связью электроноакцепторной группировки активирует алкены для взаимодействия с нуклеофильными реагентами. Главные направления атаки реагентов:
Важными реакциями окислительного присоединения к двойной связи алкенов являются реакции окисления до оксиранов и до 1,2‑гликолей. Так, этилен в промышленности окисляют кислородом воздуха на катализаторе до этиленоксида, который под действием воды раскрывается:
1,2-Гликоли образуются также при окислении алкенов перманганатом калия (реакция Вагнера) или оксидом осмия OsO4. Гомологи этилена при окислении кислородом воздуха реагируют неоднозначно, поскольку у них есть активное в условиях радикальных процессов (к которым относится окисление кислородом) аллильное положение. Для их эпоксидирования (общее название процессов получения окисей алкенов, или эпоксидов) применяют надкислоты (реакция Прилежаева):
Важное значение имеют реакции окисления, протекающие с деструкцией углеродного скелета по месту нахождения двойной связи:
Строение, номенклатура
4.1. Назовите по систематической номенклатуре следующие соединения:
4.2. Изобразите структуры всех изомерных алкенов состава С4Н8, включая стереоизомеры. Приведите названия этих изомеров по систематической номенклатуре. Укажите пространственное строение изомеров. Расположите изомеры с неразветвленной цепью атомов углерода в порядке увеличения их термодинамической устойчивости, ответ поясните.
4.3. Приведите структурные формулы возможных p-диастереомеров представленных ниже непредельных углеводородов. Укажите конфигурацию двойных связей по Z,E-номенклатуре:
4.4. Приведите структурные формулы Z- и E-изомеров следующих соединений: а) 1-бром-2-хлорпропен, б) 1,2-дибром-4-метил-3-этилпентен-2, в) 3-изопропилгептен-2.
4.5. Какие из указанных ниже алкенов могут существовать в виде цис- и транс-изомеров? Назовите эти изомеры по E,Z-номенклатуре:
Химические свойства
4.6. Какие из нижеприведенных частиц могут взаимодействовать с двойной связью алкенов? Выберите из них: а) радикалы, б) нуклеофилы, в) электрофилы.
H+, HO–, Cl–, CH3NH2, H2O, BH3, CH3×, CH3CH2+, Br×, AlCl3, NH3.
4.7.* Напишите формулы продуктов присоединения хлороводорода к приведенным ниже соединениям; рассмотрите механизм реакции и объясните направление присоединения с привлечением понятий об электронных эффектах и представлений об устойчивости промежуточных частиц. Сформулируйте правило Марковникова.
4.8. Приведите не менее трех способов образования карбокатиона. Изобразите пространственное и электронное строение метильного катиона.
4.9. Охарактеризуйте влияние электроноакцепторных и электронодонорных заместителей на устойчивость карбокатионов с привлечением понятий об электронных эффектах.
4.10. Расположите карбокатионы в ряды по возрастанию их устойчивости:
4.11.*Напишите формулу основного продукта в каждой из реакций, рассмотрите механизмы их образования:
4.12. Напишите формулы продуктов, которые образуются при реакции 1-метилциклогексена со следующими реагентами; для реагентов а, б, и, к приведите механизмы.
4.13.* Рассмотрите механизм и стереохимию приведенных реакций, изобразите пространственное строение образующихся продуктов в виде проекций Фишера: а) цис-гексен-3 + Cl2; б) транс-гексен-3 + Cl2; в) (3S)-3-хлорбутен-1 + HCl.
4.14. Предложите реагенты и условия для осуществления следующих реакций бромирования, рассмотрите механизмы реакций. Укажите, является продукт реакции (б) мезо- или dl-формой:
4.15. Какие алкены следует использовать для осуществления реакций:
4.16.* Объясните результат следующей реакции:
4.17.* Напишите формулы продуктов следующих реакций, рассмотрите механизм их образования:
4.18. Рассмотрите механизм следующей реакции:
4.20. Напишите формулы продуктов следующих реакций. В случае (в) рассмотрите механизм и стереохимию процесса.
4.21.*Какие продукты можно получить в результате гидроборирования – окисления следующих алкенов: а) 2-метилбутен-2, б) 1-метилциклогексен.
4.22. Рассмотрите схемы радикальной полимеризации этилена и пропилена. Какие две формы стереорегулярного полипропилена вам известны? Изобразите их. Что такое катализаторы Циглера-Натта и для чего их используют?
4.23. Изобразите структуру мономера, из которого можно получить полимерное соединение опанол:
4.24. При хранении циклогексена на воздухе в нем накапливается неустойчивое соединение А, которое при обработке сульфатом железа(II) дает спирт Б. Изобразите формулы А и Б и предложите схему механизма образования А в указанных условиях.
Установление структуры
4.25. Как химическим способом можно различить пентан и 1-пентен? Предложите не менее трех качественных реакций на двойную связь.
4.26. Циклический димер бутадиена А подвергли частичному озонолизу (по одной двойной связи), в результате которого получили соединение Б. Установите структуру А.
4.27.Изобразите формулы четырех различных алкенов, которые при каталитическом гидрировании образуют 2-метилгексан.
4.28.Установите строение алкена С6Н12, который при окислении хромовой смесью образует метилэтилкетон (СН3СОС2Н5) и уксусную кислоту. Приведите качественные реакции на двойную связь, отношение к концентрированной серной кислоте. Какие полосы поглощения должны наблюдаться в УФ и ИК спектрах алкена С6Н12?
4.29.Углеводород C6H10 обесцвечивает разбавленный подкисленный раствор перманганата калия, реагирует с одним молем водорода на палладиевом катализаторе при комнатной температуре. Взаимодействие углеводорода с надуксусной кислотой дает продукт C6H10O, а восстановительный озонолиз дает вещество C6H10O2. Установите возможную структуру углеводорода, если известно, что ни один из продуктов указанных реакций не может быть разделен на энантиомеры. Приведите схемы и механизмы реакций с указанием стереохимии.
4.30.* Соединение А не содержит циклов, оптически активно и имеет молекулярную формулу С6Н12. При каталитическом гидрировании оно образует соединение В (С6Н14), которое оптически неактивно и не может быть разделено на отдельные энантиомеры. Предложите структуру А.
4.31.В спектре ПМР транс-3-гексена имеются сигналы с d 0.95 м.д. (триплет), d 2.0 м.д. (мультиплет) и d 5.5 м.д. (мультиплет). Соотнесите структуру соединения с его спектром.
5. АЛКАДИЕНЫ
В зависимости от взаимного расположения двух двойных связей в молекуле алкадиена выделяют несопряженные, сопряженные и кумулированные диены (аллены). В молекулах несопряженных диенов двойные связи отделены друг от друга, как минимум, одним атомом углерода. В этом случае взаимное влияние кратных связей друг на друга незначительно, и химические свойства таких соединений практически не отличаются от свойств обычных алкенов. Химические свойства сопряженных диенов (или 1,3-диенов – тривиальные названия некоторых важных представителей приведены в табл. 5 приложения) в сравнении со свойствами обычных алкенов имеют некоторые особенности. Так, согласно квантово-механическим расчетам (по орбитали ВЗМО) на концевых атомах диеновой системы находится наибольшая электронная плотность, следовательно, атака реагентов должна направляться по атомам С1 и С4. Яркий пример реакции 1,4‑присоединения – диеновый синтез (реакция Дильса-Альдера) – взаимодействие сопряженных диенов с ненасыщенными соединениями (диенофилами). Этот процесс происходит согласованно и называется «циклоприсоединение», так как в результате реакции образуются циклические аддукты:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|