
|
|
Зависимость скорости химической реакции от концентрацииЗадачи по кинетике Химическая кинетика –раздел физической химии, изучающий химическую реакцию как процесс, протекающий во времени, механизм этого процесса, зависимость скорости реакции от условий ее осуществления. Скорость химической реакции, протекающей в газовой фазе или в растворе, – изменение концентрации одного из реагирующих веществ в единицу времени. Как правило, берется молярная концентрации и время в секундах. Тогда размерность скорости химической реакции – моль/(л•с). Различают среднюю и истинную скорости химической реакции. В реакции 2А + В = 3С средняя скоростьреакции для интервала времени
Поскольку вещества А и В расходуются в результате взаимодействия, изменение их концентрации во времени будет отрицательным, поэтому в уравнении для средней скорости реакции, выраженной через концентрации веществ А и В, будет стоять знак минус. В уравнении (1) принято ставить знак минус, если скорость реакции рассчитывается по изменению концентраций исходных веществ, при расчетах по изменению концентраций продуктов реакции – знак плюс. Истинная скорость реакции – предел выражения
где n – это стехиометрический коэффициент перед соответствующим веществом, Истинная скорость химической реакции в определенный момент времени ( Скорость химической реакции зависит от природы и концентрации реагирующих веществ, температуры, давления (если среди реагентов имеются газы). Присутствие катализатора также влияет на скорость протекания реакции.
Зависимость скорости химической реакции от концентрации Зависимость скорости химической реакции от концентрации выражается основным законом химической кинетики – законом действующих масс:скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ (сi) в некоторых степенях (ni), определяемых экспериментально.
Уравнение (3) называют также кинетическим уравнением химической реакции. Коэффициент пропорциональности kв уравнении (3) называется константой скорости химической реакции, а ni – экспериментально определяемый показатель степени при концентрации i-го компонента – порядком реакции по компоненту i. Сумма всех показателей степеней ( Для реакции 2А + В = 3С закон действующих масс имеет вид:
если реакция протекает так, как она записана, т.е. представляет собой элементарный акт. В общем случае для этой реакции выражение закона действующих масс будет иметь вид:
Если реакция разбивается на несколько стадий (элементарных актов), скорость всего процесса определяется наиболее медленной из них (если стадии последовательные) или наиболее быстрой (если стадии параллельные). Стадия, определяющая скорость всего процесса, называется лимитирующей. В уравнениях (3) – (5) k (константа скорости химической реакции) численно равна скорости химической реакции, когда произведение концентраций реагирующих веществ равно единице. Такая зависимость скорости химической реакции от концентрации будет справедлива только для гомогенных реакций, протекающих в жидкой или газообразной фазах. В этом случае реакция идет во всем объеме. Если реакция протекает с участием твердых веществ, скорость реакции будет зависеть также от размера и характера поверхности, на которой происходит реакция. Скорости реакции в гетерогенных системах определить значительно сложнее. В химической кинетике реакции классифицируют по молекулярности, т.е. по числу частиц, участвующих в элементарном акте химического превращения (моно-, би- и тримолекулярные реакции, см. таблицу), и попорядку кинетического уравнения (порядку реакции) – сумме показателей степеней при концентрациях реагирующих веществ. Таблица 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 2 –
2 – 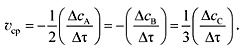 (1)
(1)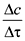 при
при 
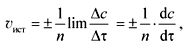 (2)
(2) (3)
(3)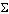 ni) называется суммарным порядком, или просто порядком реакции. Порядок реакции может быть целым, дробным, положительным, отрицательным, в том числе и нулем.
ni) называется суммарным порядком, или просто порядком реакции. Порядок реакции может быть целым, дробным, положительным, отрицательным, в том числе и нулем.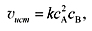 (5)
(5)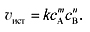 (6)
(6)