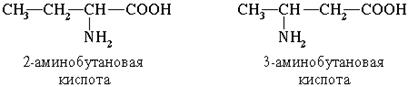ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:

Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства.Будучи производными аммиака, все амины обладают основными свойствами.
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические - более слабыми.
Это объясняется тем, что радикалы СН3-, С2Н5- и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота:
СН3 → NH2
Это приводит к усилению основных свойств.
Фенильный радикал C6H5— проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота:
 В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная:R-NH2 +H2O ⇄[R-NH3]++ OH-
В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная:R-NH2 +H2O ⇄[R-NH3]++ OH-
| | 2. Амины реагируют с кислотами, образуя соли:CH3-NH2 + H2SO4 à [CH3NH3]HSO4
C6H5NH2 + HCl à [C6H5NH3]Cl
Cоли аминов— твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
При действии щелочей на соли аминов выделяются свободные амины:
[CH3NH3]Cl + NaOH -tà CH3NH2 + NaCl + H2O
Соли аминов вступают в обменные реакции в растворе:
[CH3NH3]Cl + AgNO3 -tà [CH3NH3]NO3+ AgCl ↓
| | 3. Амины способны осаждать гидроксиды тяжелых металлов из водных растворов:2R-NH2 + FeCl2 + 2H2O à Fe(OH)2↓+ 2[RNH3]Cl
| | 4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
4 С2Н5NH2 + 15O2 à 8CO2 + 2N2 + 14 H2O
| | 5. Реакции с азотистой кислотой.
а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R-NH2 + NaNO2 + HCl à R-OH +N2 + NaCl + H2O
б) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом: R2NH + NaNO2 + HCl à R2N-N=O + NaCl + H2O
|
Особенности свойств анилина:
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
- бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
- бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).

|
АМИНОКИСЛОТЫ
Аминокислоты— органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)

Все природные аминокислоты можно разделить на следующие основные группы:
| 1) алифатические предельные аминокислоты (глицин, аланин)
| NH2-CH(CH3)-COOH
аланин
| | 2) серосодержащие аминокислоты (цистеин)
| NH2-CH(CH2SH)-COOH
цистеин
| | 3) аминокислоты с алифатической гидроксильной группой (серин)
| NH2-CH(CH2ОH)-COOH
серин
| | 4) ароматические аминокислоты (фенилаланин, тирозин)
| NH2-CH(CH2С6Н5)-COOH
фенилаланин
| | 5) аминокислоты с двумя карбоксильными группами (глутаминовая кислота, аспарагиновая кислота)
| NH2-CH(CH2СН2COOH)-COOH
глутаминовая кислота
| | 6) аминокислоты с двумя аминогруппами (лизин)
| NH2(CH2)4-CH(NH2)-COOH
лизин
| Некоторые важнейшие α-аминокислоты

| Название
| —R
| | Глицин
| —Н
| | Аланин
| —СН3
| | Цистеин
| —CH2—SH
| | Серин
| —CH2—ОН
| | Фенилаланин
| —CH2—C6H5
| | Тирозин
| 
| | Глутаминовая кислота
| —CH2 —CH2 —СООН
| | Лизин
| —(CH2)4—NH2
|
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
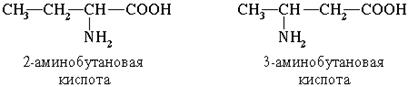
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита. Пример:

Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы NH2 – триамино- и т.д.
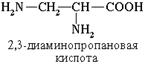
Наличие двух или трех карбоксильных групп отражается в названии суффиксом -диовая или -триовая кислота:

ПОЛУЧЕНИЕ АМИНОКИСЛОТ.
1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

2. Присоединение аммиака к α,β-непредельным кислотам с образованием β-аминокислот (против правила Марковникова):
CH2=CH–COOH + NH3 à H2N–CH2–CH2–COOH
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O2N–C6H4–COOH + 3H2 à H2N–C6H4–COOH + 2H2O
СВОЙСТВА АМИНОКИСЛОТ.
Физические свойства
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны. При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2-COOH ⇄ +H3N-CH2-COO-
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|



 В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная:R-NH2 +H2O ⇄[R-NH3]++ OH-
В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная:R-NH2 +H2O ⇄[R-NH3]++ OH-