|
Виды изомерии у алканов и галогеналканов.
1) Для алкановвозможна только структурная изомерия углеродного скелета (начиная с С4)
2) Для галогеналканов, нитроалканов характерна также изомерия положения заместителей – галогенов, нитрогрупп (начиная с С3)
СН3-СН2-СН2-Сl 1-хлорпропан СН3-СН-СН3 2-хлорпропан
׀
Cl
Получение алканов:
| 1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов:
2CH3–CH2Br + 2Na® CH3–CH2–CH2–CH3 +2NaBr
Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
А для получения несимметричных алканов используем смесь галоген производных,например:
CH3 CH3
½ ½
CH3—CH—J + 2Na + J—CH2—CH3 ¾® CH3—CH—CH2—CH3 + 2NaJ
иодистый изопропил иодистый этил 2-метилбутан
Однако нетрудно понять, что когда в реакцию вводят смесь двух галогенпроизводных, эта реакция будет протекать еще по двум направлениям, т.к. молекулы каждого из галогенпроизводных могут реагировать попарно друг с другом, а именно:
CH3 CH3 CH3 CH3
½ ½ ½ ½
CH3—CH—J + 2Na + J—CH—CH3 ¾® CH3—CH—CH—CH3 + 2NaJ
иодистый пропил иодистый пропил 2,3-диметилбутан
CH3—CH2—J + 2Na + J—CH2—CH3 ¾® CH3—CH2—CH2—CH3 + 2NaJ
иодистый этил иодитый этил бутан
| 2) Декарбоксилирование солей карбоновых кислот(реакция Дюма): сплавление со щелочами солей карбоновых кислот. Так получают метан при нагревании ацетата натрия с гидроксидом натрия.
CH3COONa + NaOH -t®CH4 + Na2CO3
 
| | 1) 3) Электролиз растворов солей карбоновых кислот(синтез Дюма):
2CH3COONa + 2H2O –(эл.ток)® 2СО2 + Н2 + С2Н6 + 2NaOH
катод: идёт разрядка воды 2Н2О + 2е ® Н2 + 2ОН-
2) анод: разрядка аниона кислоты: 2СН3СОО- -2е ® 2СО2 + СН3-СН3
3)
| | 4)Метан также можно получить гидролизом карбида алюминия.
Al4C3 + 12H2O® 3CH4 + 4Al(OH)3
| 5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). R–CH=CH–R' + H2 -kat® R–CH2–CH2–R'
 (циклопропан) + H2 -Pd® CH3 –CH2 –CH3(пропан) (циклопропан) + H2 -Pd® CH3 –CH2 –CH3(пропан)
| | 6) Предельные углеводороды от C1 до C11 выделяют фракционной перегонкой нефти, природного газа или смесей углеводородов, получаемых гидрированием угля.
| | 7) Гидрирование угля, оксида углерода в присутствии катализаторов (железо, кобальт, никель) при повышенной температуре:
n C + (n+1) H2 –400°С,p® CnH2n+2
n CO + (2n+1) H2 –200°С,Ni® CnH2n+2+ n H2O
|
Химические свойства алканов.
Алканы не взаимодействуют с концентрированными кислотами, щелочами, перманганатом калия, бромной водой. Не вступают в реакции присоединения. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
| 1)Галогенирова-ние: радикальное замещение.
Газообразные хлор и бром на свету.
| А) хлорирование:
СН3-СН2-СН3 + Cl2–(свет)à CH3-CH-CH3 + HCl
Б) бромирование: │
CH3 CH3 Cl
│ │
СН3-СН-СН3 +Br2 –(свет)à СН3-С-СН3 + HBr
│
Br
| | 2) Нитрование
(реакция М.И. Коновалова):
| нагревание до 1400С с разбавленной (10%-ной) азотной кислотой:
CH3 CH3
│ │
СН3-СН2-СН-СН3 + HNO3 à СН3-СН2-С-СН3 + H2O
│
NO2
| | 3) Крекинг
| а) CH3–CH2–CH2–CH3 -500°Cà CH3-CH3 + CH2=CH2
б) длительное нагревание метана: CH4 -1500°Cà C+ 2H2
в) мгновенное нагревание (пиролиз метана)
2CH4 -1500°C(без воздуха)à H–C≡C–H + 3H2
| | 4) Изомеризация:при нагревании с катализатором.
| СН3-СН2-СН2-СН3 -(100о, AlCl3)à CH3-CH-CH3
│
CH3
| | 5) Горение
| CH4 + 2O2 à CO2 + 2H2O C5H12 + 8O2 à 5CO2 + 6H2O
| | 6)Дегидриро-вание и циклизация.
| СН3-СН3 –(кат, t)à CH2=CH2 + Н2
В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно.
СН3-СН2-СН2-СН2-СН2-СН3 –(кат, t)à  + 4 Н2 + 4 Н2
| | 7) Окисление
| 2CH4 + O2 -t, катà 2СН3ОН
CH4 + [O] -t, катà НСООН
CH4 + [O] -t, катà НСНО
2С4Н10 + 5O2 -t, катà 2СН3СООН + 2Н2О
|
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ)
- предельные циклические углеводороды. Общая формула гомологического ряда CnH2n.

| 
| 
|

| | Циклопропан
| Циклобутан
| Циклопентан
| Циклогексан
| | Малые циклы
| Большие циклы
|
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
σ-связи в циклопропане называют "банановыми".По свойствам они напоминают p-связи.
Поэтому циклопропан способен вступать в реакции присоединения (с разрывом цикла).
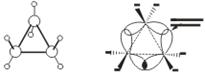
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации.

a б
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|




 (циклопропан) + H2 -Pd® CH3 –CH2 –CH3(пропан)
(циклопропан) + H2 -Pd® CH3 –CH2 –CH3(пропан)
 + 4 Н2
+ 4 Н2





