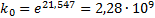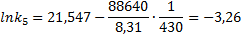|
|
Определение энергии активации и предэкспоненциального множителяИсследование 1 Раздел «Химическая кинетика» Для реакции А+В Таблица 1 Изменение концентрации исходных веществ во времени при различных температурах
Решение поставленной задачи сводится к определению конкретного вида кинетического уравнения рассматриваемой реакции, т.е. определению цифровых значений константы скорости реакции k и порядка реакции n. В общем виде кинетическое уравнение для любого порядка реакции (кроме n=1) имеет вид
Определив порядок реакции, выбирают кинетическое уравнение и решают его при известных С0 и k. В нашем случае порядок реакции удобно определить, используя два способа: метод Вант-Гоффа и метод по периоду полупревращения. Определение порядка реакции методом Вант-Гоффа Логарифмируем уравнение закона действия масс
получим выражение которое в координатах
Для построение такой зависимости необходимо иметь несколько значений скорости химической реакции Vi при нескольких концентрациях Ci. Определим эти скорости графически из кинетической кривой (рис.1), построенной по данным табл.1 для Ti=1000 К.
Рис.1. Изменение концентрации реагирующих веществ Ci во времени t при температуре 400 К
Скорость реакции V определяем для пяти произвольно выбранных концентраций С1=0,76 моль/дм3; С2=0,68 моль/дм3; С3=0,6 моль/дм3; С4=0,5 моль/дм3; С5=0,44 моль/дм3 как тангенс угла наклона касательной и кинетисческой кривой в точке пересечения значения концентрации с кривой. На рис.1 показан пример опеределения скорости реакции для С3=0,44 моль/дм3.
Аналогично определяют скорости при других концентрациях и результаты расчета вводят в табл.2. Таблица 2 Скорость реакции Vi при различных концентрациях Сi
По данным табл. 2 строим график в координатах lgV-lgC (рис.2) для определения порядка реакции, тангенс угла которого равен ni.
Рис.2. Зависимость десятичного логарифма скорости реакции V от десятичного логарифма концентрации С
Определение порядка реакции по периоду полупревращения Для определения порядка реакции вторым способом необходимо из графика (рис.1) определить несколько периодов полупревращения, например для
Определив t1/2 для всех концентраций, сведем данные в табл. 3 Таблица 3 Период полупревращения t1/2(i) при различных исходных концентрациях
Период полупревращения связан с порядком реакции уравнением
Обозначив отношение
Это выражение является уравнением прямой в координатах lgt1/2-lgC0. Построим эту прямую на рис.3 и определим порядок из уравнения n2=1-tgα
Рис. 3. Зависимость десятичного логарифма периода полупревращения t1/2 от исходной концентрации C0 Определяем из рис. 3 тангенс угла наклона прямой
Определяем порядок n2=1-(-0,33)=1,33 Поскольку порядки, найденные разными способами, различны, то истинный порядок определяем как среднее между двумя значениями:
Определим вид кинетического уравнения:
По этому уравнению, зная исходные концентрации Ci0 и текущие – Сi в момент ti, можно рассчитать константы скорости при требуемых температурах Т1-Т4. Значения исходных и текущих концентраций через 10 с от начала реакции возьмем из табл.3.
Определение энергии активации и предэкспоненциального множителя Зависимость константы скорости k от температуры Т описывается основным уравнением химической кинетики (уравнением Аррениуса)
Где k0 – предэкспоненциальный множитель; е – основание натурального логорифма; Е – энергия активации; R – универсальная газовая постоянная. В малом интервале температур (до 200 К) величины k0 b Е изменяются незначительно и их можно считать постоянными. Это допущение дает возможность определять их значения графически. После логарифмирования уравнения
Видно, что в координатах lnk-
Для построение графика сведем ранее определенные данные в табл. 4. Таблица 4 Значение константы скорости ki при различных температурах Тi
По данным табл. 4 построена зависимость, представленная на рис. 4
Рис. 4. Зависимость логарифма константы скорости от обратной температуры
Из рис. 4 определяем тангенс наклона:
и затем определяем энергию активации
Значения предэкспоненциального множителя найдем из уравнения Например, при Тогда Откуда Находим k5 при Т5=430 К.
Рассчитаем время, за которое 40% исходных веществ превратятся в продукты реакции, т.е. их концентрация изменится от значения С0=1,0 моль/дм3 до значения С=0,6С0 моль/дм3 при температуре 430 К.
Таким образом, при температуре 430 К, при исходных концентрациях реагирующих веществ С0(А)=С0(В)=С0=1 моль/дм3 40% исходных веществ прореагирует за 15,42 с.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 продукты реакции начальные концентрации веществ А и В С0(А)=С0(В)=С0=1 моль/дм3. Изменение концентрации веществ А и В во времени представлено в таблице 1. Найти энергию активации и время, за которое 25% исходных веществ при температуре Т5=950 К превратятся в продукты реакции.
продукты реакции начальные концентрации веществ А и В С0(А)=С0(В)=С0=1 моль/дм3. Изменение концентрации веществ А и В во времени представлено в таблице 1. Найти энергию активации и время, за которое 25% исходных веществ при температуре Т5=950 К превратятся в продукты реакции.


 имеет вид прямой.
имеет вид прямой.
 4,17
4,17  10-3
10-3 

 1,8
1,8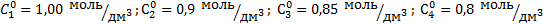 .На рис. 1 показано как определить t1/2 для
.На рис. 1 показано как определить t1/2 для  . Для этого из ординаты
. Для этого из ординаты 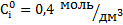 . Период полупревращения t1/2 определяют из выражения
. Период полупревращения t1/2 определяют из выражения

 моль/дм3
моль/дм3

 и прологарифмировав его получим
и прологарифмировав его получим
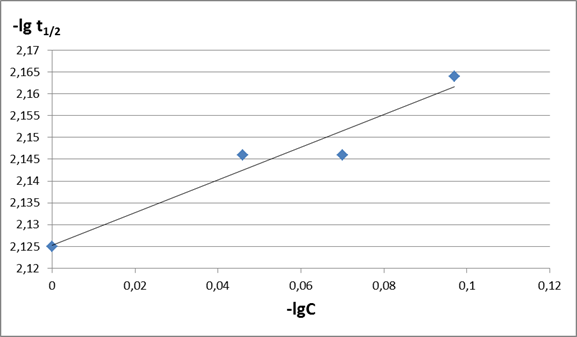
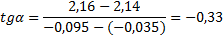
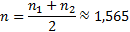






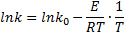
 график этой функции представляет собой прямую, тангенс угла наклона которой есть отношение Е/R, т.е.
график этой функции представляет собой прямую, тангенс угла наклона которой есть отношение Е/R, т.е.

 , К-1
, К-1



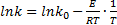 , подставив в него любую пару значений lnk и
, подставив в него любую пару значений lnk и  , взятых из рис. 4.
, взятых из рис. 4.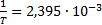 ; lnk=- 4.
; lnk=- 4.