
|
|
Определение содержания азотаТеоретическая часть Цель работы: Определение в пробе технического сульфата аммония влажности, содержания азота и бисульфата аммония. 1. 1. Определение влажности В фарфоровой ступке измельчают пробу сульфата аммония. Около 10 г измельченной соли взвешивают с точностью до 0,01 г на технических весах в предварительно взвешенном противне. Определение проводят в двух параллельных пробах. Навески на противнях разравнивают легким постукиванием и ставят их на 10 мин в сушильный шкаф при температуре 150-160°С. Затем противни вынимают из шкафа, охлаждают в течение 5 мин и взвешивают. Содержание влаги (W, % масс.) вычисляют по формуле
где а - вес противня с навеской до просушивания, г; Ь - вес противня с навеской после просушивания, г; g - навеска сульфата аммония, г. Определение содержания азота Содержание азота определяется разными методами: отгонкой со щелочью, формальдегидным и кондуктометрическим способом. В этой работе мы будем использовать отгонку со щёлочью. 1.2.1. Отгонка со щелочью Метод основан на разложении сульфата аммония раствором едкого натра и поглощении выделившегося аммиака титрованным раствором серной кислоты. По количеству раствора щелочи, пошедшего на титрование избытка кислоты, рассчитывается содержание азота. Проведение анализа
В двугорлую круглодонную колбу 1 прибора для определения содержания азота (рис. 1) вносят 50 см3 приготовленного раствора пипеткой и 150 см3 воды мерным цилиндром. Для равномерного кипения в колбу помещают кусочки пемзы. Круглодонная колба снабжена капельной воронкой 2 для подачи 20% раствора едкого натра, и через каплеуловитель 3 и вертикальный шариковый холодильник 4 соединена с приемником 5. Обогрев ведут с помощью электроплитки 6. В приемник - коническую колбу на 250 см3 наливают 50 см3 0,5 н раствора H2SO4, добавляют 50 см3 дистиллированной воды и 2-3 капли индикатора. Конец холодильника погружают в раствор примерно на 1 см. После того, как прибор проверен, подают в холодильник воду и включают обогрев. Через капельную воронку к раствору сульфата аммония приливают 40 см3 20% раствора едкого натра, оставляя небольшое количество его в воронке в качестве гидрозатвора. Жидкость в колбе нагревают до кипения. Нагрев ведется до тех пор, пока не перегонится около 2/3 исходного объема жидкости в колбе, после чего приемник с раствором кислоты опускают, освобождая, таким образом, конец холодильника. Нагревание ведут еще 10-15 мин, конденсирующиеся водяные пары омывают внутреннюю поверхность холодильника. Конец холодильника промывают дистиллированной водой. Избыток кислоты оттитровывают 0,5 н раствором NaOH в присутствии индикатора метилового красного или оранжевого. Содержание азота в сульфате аммония (N, % масс) рассчитывают по формуле
где
g - навеска сульфата аммония, г;
0,014 - количество азота, соответствующее 1 мг-экв серной кислоты, г. Определение содержания бисульфата аммония В специальной литературе часто пользуются термином «свободная серная кислота» применительно к составу технического сульфата аммония и маточного раствора сатуратора. Количество «свободной серной кислоты» условно равно половине количества бисульфат-ионов. Определение показателя «содержания свободной серной кислоты» может быть проведено потенциометрическим титрованием или титрованием в присутствии индикатора - метилоранжа. В данной работе применяется второй способ. Проведение анализа 10 г сульфата аммония, взвешенных с точностью до 0,01 г, помещают в коническую колбу на 500 см3, растворяют в 200 см3 дистиллированной воды. В колбу добавляют 2-3 капли метилоранжа и содержимое титруют 0,01н раствором едкого натра. Концентрацию бисульфата аммония (СБСА, % масс) рассчитывают по формуле
где 0,115 - масса миллиграмм-эквивалента NH4HSO4, г; g - навеска сульфата аммония, г.
Расчёты Определение влажности На технических весах взвешиваем противни, в которых будем сушить навеску: mпр,1 = 45,3836 г mпр,2 = 45,7413 г Затем берём навески сульфата аммония, их масса: mпр+нав,1 = 55,3876 г mпр+нав,2 = 55,7424 г Масса после сушки: mп.с.1 = 55,1224 г mп.с.2 = 55,3805 г Содержание влаги в пробе:
W1 =
W2 = Среднее значение влажности сульфата аммония:
Wср = Определение содержания азота Вес стаканчика: mст = 33,05605 г Вес стаканчика с навеской: mнав = 43,05605 г Определим теоретическое процентное содержание азота в сульфате аммония: Nтеор = Теперь определяем практическое содержание азота:
g = 10 г Vраз = 500 мл Vан = 50 мл Nпр,1 =
Nпр,2 = Рассчитаем среднее значение: Nср = 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ,
, В стаканчике взвешивают 10 г измельченного сульфата аммония ( с точностью до 0,01 г). Навеску растворяют в небольшом количестве дистиллированной воды и раствор количественно переносят в мерную колбу на 500 см3. Уровень раствора в колбе доводят дистиллированной водой до метки, содержимое тщательно перемешивают.
В стаканчике взвешивают 10 г измельченного сульфата аммония ( с точностью до 0,01 г). Навеску растворяют в небольшом количестве дистиллированной воды и раствор количественно переносят в мерную колбу на 500 см3. Уровень раствора в колбе доводят дистиллированной водой до метки, содержимое тщательно перемешивают.
 - объем (см3), нормальность (мг-экв/см3) и коэффициент нормальности раствора серной кислоты, взятой для поглощения аммиака;
- объем (см3), нормальность (мг-экв/см3) и коэффициент нормальности раствора серной кислоты, взятой для поглощения аммиака;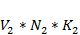 - то же, раствора едкого натра, израсходованного на титрование;
- то же, раствора едкого натра, израсходованного на титрование; - объем разведения навески, см3 (равен 500 см3);
- объем разведения навески, см3 (равен 500 см3);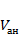 - объем пробы, взятой на анализ, см3.
- объем пробы, взятой на анализ, см3.
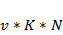 - объем (см3), нормальность (мг-экв/ см3) и коэффициент нормальности раствора NaOH, пошедшего на титрование;
- объем (см3), нормальность (мг-экв/ см3) и коэффициент нормальности раствора NaOH, пошедшего на титрование;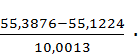 100 = 2,65 %
100 = 2,65 % 100 = 3,62 %
100 = 3,62 %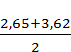 = 3,135 %
= 3,135 % ∙ 100 % = 21,20 %
∙ 100 % = 21,20 %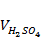 = 50 мл
= 50 мл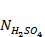 = 0,5 н
= 0,5 н = 1
= 1 = 12,0 мл;
= 12,0 мл;  = 12,6 мл
= 12,6 мл = 0,5 н
= 0,5 н = 1,57
= 1,57 ∙100 = 21,81 %
∙100 = 21,81 %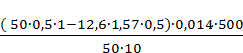 ∙100 = 21,15 %
∙100 = 21,15 % = 21,48 %
= 21,48 %