
|
|
МОЛЕКУЛЯРНОСТЬ И КИНЕТИЧЕСКИЙ ПОРЯДОК РЕАКЦИИСКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Химическая кинетика – это раздел химии, в котором изучают влияние различных факторов на скорость химической реакции и ее механизм. Рассматриваются только реакции, которые термодинамически разрешены (DGх.р < 0). Скоростью химической реакции называют изменение концентрации реагирующих веществ или продуктов реакции (DС) в единицу времени V = Средняя скорость реакции Vср в интервале времени от t1 до t2 определяется соотношением V = Мгновенная скорость – это скорость реакции в момент времени t. Она определяется производной от концентрации по времени Vt = Скорость реакции aA + bB → cC + dD экспериментально можно определять либо по убыли концентраций исходных веществ, либо по увеличению концентраций продуктов реакции:
Vt = 3 Под механизмом химической реакции понимают последовательность отдельных стадий процесса, приводящих к продуктам реакции. Стадия, имеющая наименьшую скорость, называется лимитирующей. Она определяет скорость процесса в целом. Основными факторами, влияющими на скорость химической реакции, являются: а) природа реагирующих веществ; б) концентрация реагирующих веществ; в) давление (если в реакции участвуют газы); г) температура; д) наличие катализатора; ж) площадь поверхности раздела фаз (для гетерогенных реакций). ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Влияние концентрации на скорость химической реакции выражается законом действующих масс: «При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам». Закон справедлив только для элементарных реакций. В общем виде для реакции аА+ bB = cC аналитическое выражение закона действующих масс будет иметь вид
Для конкретной реакции I2(г) + H2(г) ⇄ 2HI(г) уравнение скорости прямой реакции будет В случае гетерогенных процессов, когда реакция протекает на границе раздела фаз, в уравнение скорости входят концентрации только газообразных или растворенных веществ. Концентрация твердого вещества в процессе реакции остается постоянной и в уравнение скорости реакции не включается. Например, для гетерогенной реакции Si(тв) + O2(г) = SiO2(тв) уравнение скорости прямой реакции будет
МОЛЕКУЛЯРНОСТЬ И КИНЕТИЧЕСКИЙ ПОРЯДОК РЕАКЦИИ К элементарным реакциям применимо понятие «молекулярность реакции», которое характеризует число частиц, участвующих в элементарном взаимодействии. Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы. PCl5(г) ⇄ PCl3(г) + Cl2(г) (мономолекулярная) I2(г) + H2(г) ⇄ 2HI(г) (бимолекулярная) 2NO(г) + Cl2(г) ⇄ 2NOCl(г) (тримолекулярная) Столкновение четырех частиц одновременно невероятно. Максимально возможно столкновение трех частиц. В случае сложных реакций совокупность элементарных стадий составляет механизм химической реакции. Стадия, имеющая наименьшую скорость, является определяющей и называется лимитирующей стадией реакции. Порядок реакции определяет характер зависимости скорости от концентрации. Истинный порядок реакции определяется по уравнению, описывающему скорость лимитирующей стадии процесса, полученному из эксперимента. Таким образом, общий (суммарный) кинетический порядок реакции – сумма показателей степеней при концентрациях реагирующих веществ в уравнении лимитирующей скорости реакции, определенном экспериментально. Так, если для реакции А + В + С
то n1 + n2 + n3 = n – общий кинетический порядок реакции; n1 , n2, n3 – порядок реакции по каждому из компонентов А, В, С; n1 , n2, n3 могут быть целыми или дробными числами. Реакции, скорость которых не зависит от концентрации, имеют нулевой порядок. Для элементарных процессов n1 , n2, n3 совпадают со стехиометрическими коэффициентами в уравнении реакции, т.е. молекулярность совпадает с общим кинетическим порядком реакции. Если уравнение реакции не отражает ее механизм, порядок реакции не зависит от стехиометрических коэффициентов. Рассмотрим химическую реакцию: NO2(г) + CO(г) = NO(г) + CO2(г) Согласно уравнению реакции Поскольку порядок реакции не соответствует стехиометрическим коэффициентам ее полного уравнения, реакция не может протекать в одну стадию, которая включала бы столкновение между молекулами NO2 и CO. Установлено, что эта реакция протекает в две бимолекулярные стадии: 1) NO2(г) + NO2(г) → NO(г) + NO3(г) 2) NO3(г) + CO(г) → NO2(г) + CO2(г) Каждая из этих стадий называется элементарной реакцией. На первой стадии происходит столкновение двух молекул NO2, в результате чего атом кислорода переходит от одной из молекул NO2 к другой. Образовавшийся NO3 затем быстро передает атом кислорода молекуле CO, в результате чего получается молекула CO2 и молекула NO2. Первая стадия является лимитирующей. Она определяет скорость процесса. Суммарный порядок полной реакции определяется молекулярностью лимитирующей стадии. Частица NO3(г) является интермедиатом (промежуточным продуктом) поскольку она не входит ни в число реагентов, ни в число продуктов, а лишь образуется в одной элементарной реакции и поглощается в следующей. В этой реакции показатели степени при концентрациях реагентов (два для диоксида азота и нуль для монооксида углерода) со стехиометрическими коэффициентами не совпадают. Они отражают молекулярность (и стехиометрию) лимитирующей стадии (1) и отсутствие влияния участников второй быстрой стадии на скорость реакции в целом. Энергетическая диаграмма этого процесса представлена на рис.1.
Рис.1 Энергетическая диаграмма двухстадийной реакции NO2(г) + CO(г) = NO(г) + CO2(г)

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 . Скорость реакции измеряется в моль/л∙с, если она идет во всем объеме системы (гомогенная реакция) и в моль/м2∙с, если реакция идет на границе раздела фаз (гетерогенная реакция). Гомогенная система состоит из одной фазы, гетерогенная – из нескольких фаз. Фазойсистемы называют ее часть, отделенную от других частей физической границей и обладающую во всех точках одинаковым составом и свойствами.
. Скорость реакции измеряется в моль/л∙с, если она идет во всем объеме системы (гомогенная реакция) и в моль/м2∙с, если реакция идет на границе раздела фаз (гетерогенная реакция). Гомогенная система состоит из одной фазы, гетерогенная – из нескольких фаз. Фазойсистемы называют ее часть, отделенную от других частей физической границей и обладающую во всех точках одинаковым составом и свойствами.
 (моль/л∙с, моль/л∙час).
(моль/л∙с, моль/л∙час). =
=  =
=  =
= 
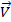 =
= 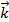 [A]a[B]b, где a и b – порядки реакции по каждому реагенту, соответствующие стехиометрическим коэффи-циентам.
[A]a[B]b, где a и b – порядки реакции по каждому реагенту, соответствующие стехиометрическим коэффи-циентам. =
= 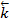 [HI]2. В этих уравнениях
[HI]2. В этих уравнениях  продукты кине-тическое уравнение, определенное экспериментально, имеет вид
продукты кине-тическое уравнение, определенное экспериментально, имеет вид =
=  ,
,

 – энергия активации первой (лимитирующей) стадии реакции,
– энергия активации первой (лимитирующей) стадии реакции,  - энергия активации второй (быстрой) стадии реакции; ПС1 и ПС2 – переходные состояния.
- энергия активации второй (быстрой) стадии реакции; ПС1 и ПС2 – переходные состояния.