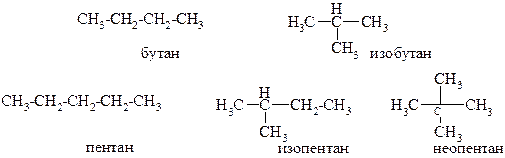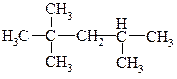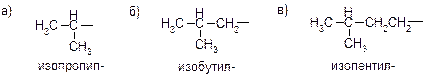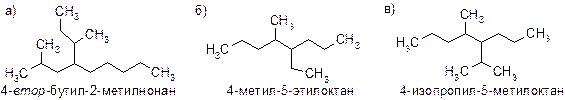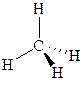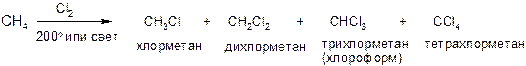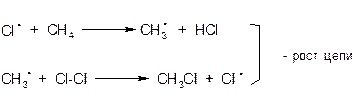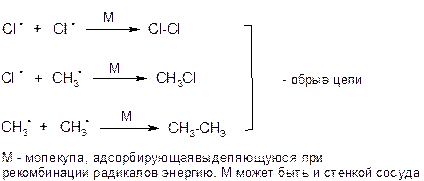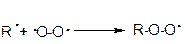|
|
РАДИКАЛЬНЫЕ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ АЛКАНОВ12 Алканы Общая формула СnH2n+2
НОМЕНКЛАТУРА АЛКАНОВ Названия нормальных алканов(в которых все атомы углерода образуют прямую, линейную цепь):
Использование префиксов «изо»- и «нео»-в названиях изомерных алканов, содержащих 4 и пять атомов углерода:
Внимание! Название «изооктан» используется как тривиальное название эталонного соединения, по которому определяют октановое число моторного топлива:
При составлении названий разветвленных алканов по систематической номенклатуре IUPAC (заместительный принцип – см. тему «Классификация и номенклатура органических соединений») необходимо найти главную цепь (самую длинную) – название соответствующего линейного алкана лежит в основе названия всего соединения. Названия алкильных заместителей, в свою очередь, происходят от названий соответствующих алканов с заменой окончания «ан» на «ил». Использование буквенных обозначений алкильных групп:
*От устаревшего названия пентильной группы «амил» Использование префиксов изо-, втор, трет-, нео-в названиях простых разветвленных алкильных групп:
Примеры:
Строение алканов Молекула метана представляет собой правильную треугольную пирамиду – тетраэдр, все четыре связи С-Н в которой равноценны (энергия С-Н связи 415 кДж/моль, длина С-Н связи 0.109 нм), а валентные углы Н-С-Н составляют 109°5’:
Для описания простых s (сигма)-связей в молекуле метана используют концепцию гибридизации – s-связи С-Н образованы sp3-гибридными орбиталями атома углерода. В гомологах метана имеются также s-связи С-С (длина С-С связи 0,154 нм). Углерод-углеродная s-связь симметрична вдоль оси связи, и это допускает свободное вращение вокруг простой связи. Различные пространственные формы молекул, возникающие в результате вращения вокруг простых углерод-углеродных связей, называются конформациями. Представление конформаций с помощью проекций Ньюмена см. в разделе «конформации» Физические свойства алканов Это бесцветные вещества, легче воды (относительная плотность < 1), с водой практически не смешиваются. С увеличением количества атомов углерода в молекуле алкана температуры кипения и плавления повышаются (исключение – для Т. пл. первых трех членов ряда).
Агрегантое состояние н-алканов:
Физические свойства изомеров:для более разветвленного алкана характерна более низкая температура кипения:
РАДИКАЛЬНЫЕ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ АЛКАНОВ Энергия диссоциации на ионы неполярных связей в алканах слишком велика, например, для метана энергия ионизации молекулы на метильный катион и гидрид-ион составляет 314 ккал/моль. Поэтому в обычных условиях алканы не вступают в реакции, протекающие по ионному механизму (с гетеролитическим разрывом связей). Энергия же гомолитического разрыва неполярной связи С–Н в три раза ниже энергии гетеролитического разрыва, и вследствие этого для алканов характерны прежде всего радикальные реакции, наиболее важными из которых являются реакции галогенирования и окисления.
Общая схема моногалогенирования алканов:
Образующиеся моногалогеналканы в условиях реакции могут подвергаться дальнейшему галогенированию. Пример: промышленно-важная реакция хлорирования метана:
Все продукты (которые имеют большое практическое значение) разделяют фракционированием. Цепной свободнорадикальный механизм реакции хлорирования метана:
Доказательства цепного свободнорадикального механизма хлорирования метана: 1) в реакции хлорирования метана всегда образуется некоторое количество этана – продукта рекомбинации двух метильных радикалов;
2) хлор не реагирует с метаном при комнатной температуре или в темноте. Для протекания реакции необходима энергия, достаточная для гомолитического разрыва связи Cl-Cl;
3) хлор не реагирует с метаном, если его смешать с кислородом, даже при облучении реакционной смеси. Кислород в основном состоянии представляет собой бирадикал ×О-О×, который энергично взаимодействует с алкильными радикалами (рис. 5), тем самым сильно тормозя (ингибируя) свободнорадикальную реакцию хлорирования.
Наоборот, тетраэтилсвинец, в отличие от кислорода, способствует хлорированию метана. Тетраэтилсвинец является металлоорганическим соединением с ковалентной связью C-Pb, причем энергия этой связи очень мала (31 ккал/моль), и даже при умеренном нагревании или облучении тетраэтилсвинец разлагается с образованием свинца и этильных радикалов:
Последние служат инициаторами цепного радикального процесса;
4) радикалы могут вызывать химические реакции, в частности, полимеризацию. Эта простая качественная проба часто применяется при исследовании механизмов реакций: для этого прибавляют, например, акрилонитрил.
Радикал, образовавшийся в результате реакции инициирования, может дать целую цепь радикальных превращений; длина этой цепи зависит от отношения скорости роста цепи к скорости стартовой реакции и реакции обрыва и переноса цепи, которые, в свою очередь, связаны с тепловыми эффектами этих элементарных актов реакций.
1) Тепловой эффект реакции фторирования метана составляет -104 ккал/моль. Все стадии роста цепи экзотермичны, и реакция алканов со фтором обычно протекает со взрывом даже в темноте.
2) Тепловой эффект реакции хлорирования метана составляет -25 ккал/моль, и число превращений в хлорметан на один атом хлора, образующийся при освещении, может достигать 104-106, вследствие чего при солнечном освещении реакция может протекать со взрывом.
1) Тепловой эффект реакции бромирования в целом невелик (-8 ккал/моль), и она протекает намного медленнее хлорирования и из-за стадий обрыва цепи существенно замедляется (затухает). Например, при фотохимически индуцируемом бромировании циклогексана в газовой фазе при комнатной температуре число превращений на один атом брома равно примерно 2, а при 100 оС – 12-27.
2) Реакция иодирования алканов эндотермична (тепловой эффект реакции иодирования метана составляет +13 ккал/моль), и прямое иодирование алканов обычно не происходит. При высоких температурах образующийся иодоводород легко восстанавливает иодалкан обратно до алкана.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|