
|
|
Отдельные представители и их применение.ЛЕКЦИЯ №48. АМИНЫ. АНИЛИН. План 1. Общая характеристика. 2. Номенклатура. 3. Физические и химические свойства. 4. Получение и применение.
Общая характеристика аминов. Амины – производные аммиака, в котором атомы водорода замещены на углеводородный радикал. Амины бывают: 1) Первичные. СН3—NH2 ( метиламин ) – это амины из углеводородного радикала и группы NH2.
Общая формула: N—H
2) Вторичные – это производные аммиака, в котором два атома водорода замещены углеводородными радикалами.
H диметиламин 3) Третичные – производные аммиака, в котором все 3 атома водорода замещены углеводородными радикалами. CH3
R2 триметиламин
4) Четвертичные – амины, получающиеся из третичных путем присоединения радикала к атому азота за счет донорно-акцепторной связи. CH3
По природе углеводородных радикалов амины делятся на 1) алифатические 2) алициклические 3) ароматические 4) смешанные Диамины – это органические соединения, содержащие две группы – NH2. а) Н2N—CH2—CH2—NH2 б) H2N— ( CN2 )6—NH2 этилендиамин гексаметилендиамин – 1,6
Применяют для получения волокна нейлона.
Номенклатура аминов. Амины называют с суффиксом – аминна конце. 3 2 1 а) СН3—СН—СН2—NH2 б) СН3—NH2 │ метиламин CH3 2-метилпропанамин-1
в) CH3—NH―CH3 г) СН3—СН2—N—CH2—CH2—CH3 диметиламин │ CH3 метилпропилэтиламин
Изомерия аминов. Для аминов характерен следующий вид изомерии: 1) изомерия углеродного скелета 2) изомерия положения аминогруппы
Физические свойства. Низшие амины (метиламин, диметиламин, триметиламин) при нормальных условиях – газы, имеющие запах аммиака. Средние члены ряда аминов – жидкости со слабым запахом, высшие – твердые вещества без запаха.
Способы получения. 1) Из галогеноалканов ( аммонолиз галогеноалканов). С2Н5OH, t С2Н5OH, t CH3J + NH3 ————→ [ CH3NH3 ]J- + NH3————→CH3—NH2 иодметан метиламмоний – NH4J метиламин йодид йодид аммония
2) При действии на соли аминов щелочей выделяются амины:
[ СН3NH3+ ]Cl- + NaOH——→ CH3NH2 + NaCl + H2O хлорид метиламмонил метиламин
3) Реакция Зинина (получение аминов из нитросоединений):
+2 [ H+ ] +4 [ H+ ] С6Н5NO2 —————→C6H5—N═O ————→ C6H5—NH2 нитробензол – H2O нитрозобензол – H2O анилин
Водород, используемый в данной реакции, получают при взаимодействии металлов с серной или хлороводородной кислотами. 4) Получение из нитрилов. t, K CH3—C≡N + 2H2 ———→ CH3—CH2—NH2 этанонитрил этиламин
5) Из амидов кислот ( реакция Гофмановского, расщепления ) O t, K=LiAlH4 // ( алюмогидрид лития ) R—C + NaBrO ——————→ R—NH2 + CO2↑ + NaBr \ гипобромид амин NH2 натрия амид
Химические свойства.
нуклеофильный центр H
Неподеленная пара электронов азота обуславливает основные свойства аминов. В ароматических аминах аминогруппа участвует в сопряжении с π-электронным облаком бензольного кольца. В связи с этим ароматические амины более слабые основания.
а) CH3—NH2 + HCl ——→ [ CH3NH3+ ]Cl- ——→ CH3 — NH2 метиламин метиламмоний – KCl метиламин хлорид – H2O
б) ( СН3 )2NH + HCl ——→ [ ( CH3)2NH2+ ]Cl- диметиламмоний хлорид ·· в) (CH3)3N + HCl ——→ [ (CH3)3NH+]Cl- триметиламмоний хлорид
г) C6H5—NH2 + H2SO4 ——→ [ C6H5NH3+ ]HSO4 фениламин гидросульфат- (анилин) фениламмония
·· а) R—NH2 + HOH ———→ [ R—NH3+ ]OH- ·· гидроксид … аммония б) R—NH + H2O ———→ [ (R)2 NH2+ ]OH- | R гидрооксид ди… аммония ·· в) R—N—R + H2O ——→ [ (R)3 NH+ ]OH- | гидрооксид три… аммония R
Алкилирование аминов ( реакция Гофмана ) t H3C—NH2 + CH3J——→[ CH3—NH2—CH3+ ]J- + NaOH——→CH3—NH—CH3 ( первичный амин ) диметиламмоний – NaJ диметиламин йодид – H2O (вторичный амин) Соли аминов – кристаллические вещества, растворимые в воде, водные растворы их проводят электрический ток.
Ацилирование аминов ( реакция Гофмана ) O O // t, K ║ C6H5—NH2 + CH3—C—Cl ———→C6H5—NH—C—CH3 анилин хлорангидрид анилид уксусной к-ты
Горение аминов: t 4CH3NH2 + 9O2 ———→ 4CO2↑ + 2N2↑ + JOH2O метиламин
Галогенирование ( качественная реакция на анилин )
а) + 3Br2 ————→ – 3HBr Br—— —— Br
анилин 2,4,6 – триброманилин белого цвета
орто-броманилин t=20˚C –
Br —— пара-броманилин Сульфирование:
t=200ºC —— NH2 орто-аминобен-
– H2O t=200ºC ____NH2 сульфаниловая к-та HO3S ___ (пара-аминобензол- сульфакислота)
SO2—NH2 – Cтрептоцид
Реакция с азотистой кислотой: а) R—NH2 + HONO ——→ R—OH + N2↑ + H2O первичный азотистая спирт амин кислота
б) R—NH + HONO——→R—N—N ═ O + H2O │ │ R R нитрозоамин
Отдельные представители и их применение. 1. МетиламинСН3—NH2 . Газ с запахом NH3. Используется в кожевенной промышленности, в синтезе лекарственных средств.
2. Фениламин С6Н5—NH2. (анилин) Бесцветная маслообразная жидкость, тяжелее воды, яд ! При окислении становится красно-бурого цвета, со слабым запахом, малорастворим в воде, хорошо в спирте, эфире, бензоле. Используют для синтеза сульфаниламидов, анестезина.
Качественные реакции на анилин. 1) анилин + хлорная известь ———→ фиолетовое окрашивание 2) анилин + лингин + HCl ———→ ярко-желтый цвет (для определения качества бумаги ) 3) образование 2,4,6-трибромаанилина. Анилин используется для получения красителей, пластмасс, проявителей. 4) Дифениламин: C6H5—NH—C6H5 , качественный реактив на азотную и азотис- тую кислоту, на нитрит и нитрат ионы. В присутствии конц. серной к-ты с этими ионами дифениламин дает синее окрашивание. 5) Триметиламин: CH3—N—CH3 , газ неприятного запаха, содержится в цветах │ CH3 боярышника, селедочном рассоле. 6) Бутандиамин – 1,4 NH2—( CH2 )4—NH2 , кристаллическое вещество, содер- жится в гнойных выделениях. Название путресцин произошло от латинского слова «путресцера» – гноиться. 7) Пентандиамин – 1,5 NH2—(CH2)5—NH2 . Жидкость, содержащаяся в раз- лагающихся трупах. Называется кадаверин от латинского слова «кадавер»- труп.
Качественная реакция на первичные амины:
CH3NH2 + CHCl3 + 3KOH ———→ CH3—N ≡ C↑ + 3KCl + 3H2O метилизонитрил Метилизонитрил имеет неприятный специфический запах. Домашнее задание: Г. М. Чернобельская «Общая химия», Москва, «Медицина», 1991 г.; стр. 491-497.
Вопросы для закрепления:
1.Определение аминов. 2.Какие бывают амины? 3.Функциональная группа аминов. 4.Чем определяется основный характер аминов? 5.Какие свойства проявляет анилин?

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 R
R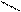 H
H R
R Общая формула: N—R1 . CH3 – NH – CH3
Общая формула: N—R1 . CH3 – NH – CH3 R |
R | Общая формула: N—R1 . CH3 – N – CH3
Общая формула: N—R1 . CH3 – N – CH3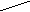 R |
R | Общая формула:N ——R1 CH3 – N – CH3
Общая формула:N ——R1 CH3 – N – CH3

 ·· R2 ··
·· R2 ·· R3 донорно-акцепторная связь CH3
R3 донорно-акцепторная связь CH3
 ··
·· I. Основные свойства аминов: R—CH2 ———— N — H основной центр
I. Основные свойства аминов: R—CH2 ———— N — H основной центр



 +KOH
+KOH

 —— Br
—— Br


 + Br2
+ Br2 – HBr —— Br
– HBr —— Br HBr
HBr —— NH2
—— NH2


 + OH—SO3—H золсульфокис-
+ OH—SO3—H золсульфокис-
 – H2O SO3H лота
– H2O SO3H лота
 Общая формула
Общая формула SO2—NH—R
SO2—NH—R

 ║
║
 Группа —N═O называется нитрозогруппой
Группа —N═O называется нитрозогруппой