|
|
Опыт 4. Образование солей анилина и их разложение.Лабораторная работа №6 Нитросоединения. Амины.
Цель: экспериментальное получение и изучение свойств аминов и нитросоединений. Опыт 1. Определение строения аминов. Реактивы и материалы: анилин; дифениламин; диметиланилин; нитрит натрия, 0,5 н. раствор; β-нафтол, щелочной раствор; соляная кислота; щелочь, 2 н. раствор. 1.В три пробирки вносят по капле или несколько кристаллов испытуемых аминов, 2 капли соляной кислоты и 3 капли раствора нитрита натрия. Взбалтывают содержимое и добавляют каплю щелочного раствора β-нафтола. Появление окраски доказывает, что в данной пробирке находится первичный амин. 2.Содержимое двух пробирок, в которых не появилась окраска, подщелачивают, добавляя по 4 капли раствора щелочи. Появление зеленой окраски служит доказательством того, что данный амин является третичным жирноароматическим амином, который в этих условиях дает пара-нитрозамин. Опыт 2. Свойства аминов жирного ряда. Реактивы и материалы: метиламин, водный раствор; фенолфталеин, 1%-нын спиртовой раствор; хлороформ; едкий натр, концентрированный раствор; сульфат меди (II), 0,02 н. раствор; хлорид железа, 0,1 н. раствор; соляная кислота (d=l,19 г/см3); лакмусовая бумага красная. 1.Проверка водного раствора на индикаторы. К отверстию газоотводной трубки прибора для получения метиламина подносят влажную красную лакмусовую бумажку. Бумажка синеет. В пробирку помещают 2 капли водного раствора метиламина и добавляют 1 каплю раствора фенолфталеина. Появляется розовое окрашивание. Химизм процесса: CH3NH2 + H2O ↔ [CH3NH3]+OH- ↔ [CH3NH3]+ + OH- Метиламин гидроокись ион метиламмония метиламония В водных растворах амины, подобно аммиаку, содержатся в виде гидроокисей замещенного аммония, которые в результате электролитической диссоциации образуют ион замещенного аммония и гидроксил. Поэтому водные растворы аминов имеют щелочную реакцию. 2.Изонитрильная реакция. В пробирку помещают 3 капли раствора метиламина, 1 каплю хлороформа, 1 каплю концентрированного раствора щелочи и нагревают смесь. Появляется характерный, очень неприятный запах изонитрила. Химизм процесса: CH3 – NH2 + CHCl3 → CH3–N=C + 3HCl Эта реакция является специфической реакцией для открытия первичных аминов. Примечание: так как изонитрил очень ядовит, после проведения опыта его разлагают. Пробирку с изонитрилом помещают в стакан с разбавленной серной или соляной кислотой. Изонитрил быстро гидролизуется с образованием соли амина и муравьиной кислоты: CH3–N=C + HCl + 2H2O → [CH3NH3]+Cl- + HCOOH 3. Реакция с раствором сульфата меди. В пробирку помещают 2 капли раствора метиламина и добавляют 2 капли сульфата меди (II) - выпадает голубой осадок. К реакционной смеси добавляют по каплям избыток раствора амина. Осадок растворяется, раствор окрашивается в интенсивный фиолетовый цвет. Из раствора солей меди (II) метиламин как довольно сильное основание осаждает гидроксид меди, а избыток амина образует с ионами меди комплексные соединения, легко растворимые в воде. 4.Реакция с раствором хлорида железа. В пробирку вводят 2-3 капли раствора метиламина и добавляют несколько капель раствора хлорида железа FeCl3. Выпадает осадок гидроксида железа (III) Fe(OH)3: 3[CH3NH3]+OH- + FeCl3 → 3[CH3NH3]+Cl- + Fe(OH)3 5.Реакция газообразного метиламина с концентрированной соляной кислотой. К отверстию газоотводной трубки прибора для получения метиламина подносят стеклянную палочку, смоченную концентрированной соляной кислотой. Образуется белый осадок солянокислой соли метиламина: CH3NH2 + HCl → [CH3NH3+]Cl- Амины как производные аммиака проявляют основные свойства и являются органическими основаниями. Опыт 3. Получение анилина из нитробензола. Реактивы и материалы: нитробензол; соляная кислота (d= 1,19 г/см3); олово металлическое, гранулированное; едкий натр, концентрированный раствор; едкий натр, 0,5 н. раствор; серная кислота (d= 1,84 г/см3); дихромат калия, 0,5 н. раствор; лакмусовая бумага красная. Оборудование: пипетка с капиллярным отверстием. В пробирку помещают маленькую гранулу олова, 5 капель соляной кислоты и 1 каплю нитробензола из пипетки с капиллярным отверстием. Смесь слегка нагревают в пламени горелки и все время тщательно взбалтывают. Если реакция замедляется, содержимое пробирки снова подогревают и продолжают опыт. Реакцию прекращают после исчезновения горько-миндального запаха нитробензола. Смесь охлаждают и по каплям добавляют раствор щелочи до щелочной реакции на лакмус. Химизм процесса: C6H5NO2 + 3Sn +6HCl → [C6H5NH3+]Cl + 3SnCl2 + 2H2O Для доказательства образования анилина к смеси добавляют каплю 0,5 н. раствора дихромата калия. Появляется темно-зеленое или темно-синее окрашивание. Опыт 4. Образование солей анилина и их разложение. Реактивы и материалы: анилин; серная кислота, 2 н. раствор; соляная кислота (d=1,19 г/см3); едкий натр, 2 н. раствор; фенолфталеин, 1%-ный спиртной раствор, лакмусовая бумага красная. Оборудование: микроскоп; предметные стекла; стеклянная палочка
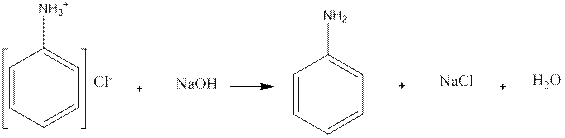
2.Приготовленную эмульсию анилина делят па две части. К одной части добавляют по каплям раствор серной кислоты. Рис. 2. Образуется осадок сернокислого анилина. Нагревают пробирку до растворения осадка и медленно охлаждают. Выпавшие игольчатые кристаллы переносят на предметное стекло и рассматривают их форму в микроскоп (рис. 2). Химизм процесса: 3. К другой части эмульсии анилина добавляют по каплям концентрированную соляную кислоту до получения однородного раствора. К прозрачному раствору солянокислого анилина добавляют 1-2 капли фенолфталеина и по каплям раствор щелочи. Жидкость мутнеет еще до появления малиновой окраски. Химизм процесса:
Основные свойства аминогруппы, связанной с ароматическим ядром, значительно ослаблены по сравнению с аминами жирного ряда. Водный раствор анилина не окрашивает лакмус в синий цвет. Анилин образует соли только с сильными минеральными кислотами. Водные растворы этих солей имеют кислую реакцию и их можно титровать щелочами. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 1.В пробирку помещаю 1 каплю анилина, 8 капель воды и встряхивают содержимое пробирки. Одну каплю эмульсии наносят на лакмусною бумажку. Цвет красного лакмуса не меняется,
1.В пробирку помещаю 1 каплю анилина, 8 капель воды и встряхивают содержимое пробирки. Одну каплю эмульсии наносят на лакмусною бумажку. Цвет красного лакмуса не меняется,