
|
|
Порядок выполнения работыТеоретические сведения
В настоящее время весь магний, выпускаемый в России, получают электролизом расплавленных хлоридов, содержащих MgCI2. Сырьем для производства магния в основном служит карналлит (КСl ∙ MgC12 ∙ 6Н В качестве электролита для электролитического получения магния обычно используют расплавленныe тройныe или четверныe смеси хлоридов магния, калия, натрия, кальция и бария. Возможно использование для электролиза магния электролитов, содержащих значительное количество хлорида лития. При электролизе магния существенную роль играет соотношение между плотностью электролита и расплавленным магнием. Если плотность электролита мало отличается от плотности магния, то последний плохо всплывает на поверхность расплава и не собирается в большие массы. Малейшее утяжеление капель магния, вызываемое побочными процессами, способствует тому, что они осаждаются на дно ванны. Иногда для увеличения плотности электролита в него добавляютСаС12 или BaC12. Высокая плотность электролита тоже нежелательна. В этом случае поверхность всплывших капель магния может обнажаться в результате разрыва смачивающих их пленок электролита, и магний легко будет окисляться кислородом воздуха. Оптимальная разница между плотностью электролита и расплавленного магния составляет 0,03-0,15. Не менее важна при электролитическом получении магния вязкость электролита. Чем меньше вязкость электролита, тем легче отделяется от него магний и лучше оседает юлам. Вязкость электролита влияет на размеры выделяющихся на аноде пузырьков хлора и на скорость их движения к поверхности расплава. Одно из условий получения высоких выходов магния по току хорошая смачиваемость стального катода жидким металлом. Для улучшения смачиваемости катодной поверхности жидким магнием в электролит добавляют CaF2 или NaF. Электролит должен достаточно хорошо смачивать корольки магния, предохраняя их от окисления при всплытии на поверхность расплава. Электропроводность - одно из важнейших свойств электролита, которое существенно влияет на показатели работы магниевого электролизера. Повышение электропроводности электролита позволяет увеличить плотность тока и межполюсное расстояние, а следовательно, интенсифицировать процесс электролиза без увеличения удельного расхода электроэнергии. Величины удельной электропроводности некоторых индивидуальныx солей при температурах немного выше точек их темпера расплавления показывают, что наиболее высоки удельные электропроводности у расплавленных NaCl и LiCl:
Поэтому для повышения электропроводности целесообразно применять электролиты с высокими концентрациями NaCl и LiCl. С повышением температуры проводимость хлоридных расплавов увеличивается. При прохождении тока в магниевом электролизере протекает реакция разложения: MgC12 Рассчитанное напряжение разложения MgC12 при температуре его плавления составляет 2,507 В, а температурный коэффициент _ 0,560 . 10-3 В/град, что хорошо согласуется с экспериментальными значениями напряжения разложения MgCl2, равными 2,50-2,59 В, и температурного коэффициента (0,56-1,0)10-3 В/град. Разбавление MgC12 хлоридом другого металла приводит к повышению напряжения разложения. Поскольку потенциал графитового анода в хлоридныx электролитах при добавлении другой соли остается постоянны,, то увеличение напряжения разложения MgC12 определяется сдвигом потенциала катода в электроотрицательную сторону за счет снижения активности ионов магния. Напряжение разложения MgCl2 в его смесях с другими хлоридами можно рассчитать по формуле
если известна активность MgCl2 в данном расплаве. По расчетным данным напряжение разложения MgCl2 при 750 °С в расплаве MgC12 и КСl при их молярном соотношении 1:3; 1:1; 2:1 составляет, соответственно, 2,687; 2,587; 2,519 В. В промышленных электролитах концентрация MgC12 не превышает 10-20 % мас. и напряжение разложения MgC1 На катоде одновременно возможны следующие реакции: Mg+ + e Mg Mg для которых в электролите KCI-NаСl- 10 % мас. MgC12 при 720 ос указаны стандартные потенциалы относительно хлорного электрода. Из значений потенциалов видим, что на катоде будут идти в основном процессы (1) и (2), а вероятность перезаряда ионов магния незначительна. Скорости катодных реакций (1-3) определяются концентрацией ионов Mg2+ и Mg+ в при электродном слое. Электрохимическая поляризация на катоде практически равна нулю, поэтому в и электродном слое должна установиться концентрация ионов Mg+ и Mg2+, соответствующая условиям равновесия реакции Mg + MgC12 при данной активности ионов магния и температуре расплава. Диффузия ионов Mg+ и их конвективный перенос в глубь электролита, содержащего кислород и хлор, влечет за собой их окисление. Убыль в электролите Mg+ нарушает равновесие реакции (4), которое восстанавливается реакцией (1). Константа равновесия реакции (4) в расплаве KCl-NаСl-МgСl2 k=-7120/ Т+ 1,46. Следовательно, равновесие реакции (4) при температурах, соответствующих электролизу магния, Сильно сдвинуто влево. Малая концентрация ионов Мg На графитовом аноде магниевой ванны практически идет только разряд ионов хлора: 2С1 Выход магния и хлора по току и удельный расход электроэнергии зависят от потерь магния и хлора в результате побочных химических и электрохимических процессов в объеме электролита и на электродах, а также от потерь магния со шламом и отработанным электролитом и уноса хлора с газами катодного отсоса. На выход магния по току влияют концентрация MgC12 в электролите и катодная плотность тока. Понижение выхода по току MgCI2, % мас. от оптимального при повышении реакции (4) вправо и следовательно, все большими количествами ионов Mg+, окисляемыми анодным хлором и растворенными в электролите O2 и Н2О. Кроме того, при повышенных концентрациях MgCl2 также более интенсивно идет гидролиз MgCl2. При концентрациях < 20 % мас. MgC12 выход по току от максимального вновь понижается, причем его значение при плотности тока 1 A/см2 ниже выходов по току, наблюдаемых при плотности тока 0,5 A/см2. Понижение выхода по току вызвано возникновением концентрационной поляризации для ионов магния и началом разряда ионов щелочных металлов. Заводской практикой установлено, что концентрация MgC12 в электролите при питании карналлитом после его заливки в ванну должна быть не выше 8-15 %, а перед заливкой - не ниже 5-7 %. Удалять отработанный электролит с содержанием больше 5-7 % мас. MgC12 не выгодно, Т.к. при этом теряется большое количество MgCl2. При работе ванны на возвратном MgC1 Температура электролиза магния выше оптимальной (700-720 В электролитах магниевых ванн, кроме основных компонентов, содержатся примеси, часть которых может существенно влиять на процесс электролиза. Присутствие примесей в электролите может быть причиной снижения выхода магния по току, образования больших количеств шлама, выпуска несортного металла и снижения концентрации хлора в анодных газах. Попавшая в электролит влага за счет плохо обезвоженного сырья и в результате взаимодействия расплава с влагой воздуха вызывает ряд вредных побочных процессов: вода подвергается электролитическому разложению; выделяющийся на аноде кислород, взаимодействуя с углеродом анода и образуя СО и СО2 вызывает быстрое срабатывание анодов. На разложение воды расходуется добавочная электроэнергия. Магний, имеющийся в электролите, будет реагировать с водой по реакции Mg + Н2О = MgO + Н2 вызывая потери металла. Снижение выхода по току вследствие электролиза воды и прямые потери магния за счет реакции с влагой в целом незначительны, Т.к. в электролите содержание влаги невелико (~ 0,1 %). Основной недостаток заключается в том, что влага, взаимодействуя с магнием на катоде, покрывает его поверхность пассивирующей пленкой из оксида магния. Это ухудшает смачивание стального катода расплавленным магнием, что приводит к образованию на катоде мелких капель магния - «икры». Магниевые «икринки» циркулирующим электролитом легко переносятся в зону анода, где магний активно вступает в реакцию с хлором, в результате чего резко снижается выход по току. Кроме того, они обволакиваются оксидом магния, утяжеляются и оседают в шлам, вызывая дополнительные потери металла. Присутствие влаги в электролите будет способствовать образованию Гидрооксихлорида магния: MgC12 + Н2О = MgOHCl + НСl диссоциирующего в расплаве: MgOHCl =MgOH+ + Cl- Предполагается, что на катоде ион MgOH MgOH+ + е = MgO + 1/2Н вызывая выделение водорода и покрывая катод пленкой MgO. Присутствие влаги в электролите способствует пассивации катода, а отсасываемый анодный газ будет содержать значительные количества НС1 и С0 Примесь железа в виде ионов Fe ход магния по току, уменьшая его до 63,3 %. В электролит железо попадает с сырьем в результате коррозии стального инструмента и конструктивных элементов ванн. В электролизерах с нижним вводом анодов основная масса железа может попадать в электролит в следствие электрохимического растворения чугунных контактов при соприкосновении с электролитом через поврежденную футеровку. Ионы железа восстанавливаются на катоде в виде губчатого осадка. Слой губчатого железа адсорбирует из электролита дисперсный оксид магния и вызывает пассивацию катода. Магний на таком катоде осаждается в виде мелких капель, что ведет к снижению его выхода по току. В присутствии железа в электролите увеличиваются потери магния в шлак в результате утяжеления капель магния частицами восстановленного железа. Магний может теряться вследствие реакции обмена: 2FеС13 + 3Mg = 3MgC1 Сульфаты, попадающие в электролит с сырьем, реагируют с магнием по реакции Mg При длительном питании ванны сырьем с повышенным содержанием сульфатов на катоде образуется толстая пассивирующая пленка, состоящая из оксида магния, сульфидов, элементарной серы, железа; магний выделяется в виде «икры», наблюдается значительная поляризация катода, начинается разряд щелочного металла, напряжение на электродах растет, а выход магния по току падает. В этих условиях нарушается нормальная циркуляция электролита, появляется грязно-белая «пена», увлекающая магний в анодную зону. Электролит прекращает «кипеть», когда содержание 80/- в нем снижается до 0,05-0,01 % мас. Допустимая концентрация 80/- в электролите должна быть менее 0,03 % мас. При электролизе магния с поступающим сырьем в электролит также попадает некоторое количество более электроположительных пpимеceй (Si, А1, Mn, Ni, Cr), которые будут вытесняться магнием из электролита за счет обменных реакций. Вытесненные примеси оседают на капельках магния и переходят в шлам. Магниевый электролит самоочищается, но все же незначительное количество ионов примесей восстанавливается на катоде и попадает в получаемый магний. Таким образом, примеси в основном вызывают пассивность катодов. Вероятность пассивации катодов можно уменьшить введением в электролит добавок фторидов натрия или кальция, которые растворяют пленку оксида магния. Если этим не прекращается пассивация, то прибегают к работе без добавки хлорида магния или карналлита в электролит. При этом будут выделяться щелочные металлы на катоды, что может депассивировать катод. При прохождении тока катионы калия и натрия проникают через пассивирующую пленку, разряжаются на катоде и разрывают пленку. Если же и это не помогает, то катод извлекают из ванны и заменяют на новый, что возможно только на диафрагменных электролизерах. Промышленный электролиз магния ведут в мощных бездиафрагменных электролизерах при 1 ~ 90 кА Порядок выполнения работы 1. Обезвоживание карнaллита и хлорида магния. Для обезвоживания карналлита или хлорида магния в лабораторных условиях искусственно создают повышенную концентрацию хлорида водорода над нагреваемой солью. Обезвоживание обычно осуществляют в две стадии. Сначала карналлит или смесь хлорида магния с хлоридом аммония загружают в фарфоровые чашки и, нагрев до 170-180 осв сушильном шкафу, выдерживают 40-50 ч при этой температуре. В результате получается продукт, содержащий приблизительно две молекулы воды. Дальнейшее обезвоживание соли ведут в кварцевом стакане с кварцевой трубкой, через которую все время при нагреве в стакан подают НСl или С1 2. Электролиз хлорида магния. Основная часть установки для электролитического получения магния представлена на рисунке 1. Электролизная ячейка представляет широкий кварцевый сосуд 7, вставленный в стальной стакан 8, который, в свою очередь, помещен в электрическую печь 9. Катодом служит пластинка из нержавеющей стали 1, к которой приварен токоподвод. При электролизе магния на катодный токоподвод надевается защитная кварцевая трубка. В качестве анода используется плоский графитовый электрод 3, находящийся в кварцевой трубе-диафрагме 5. Сверху диафрагма плотно закрыта резиновой пробкой 4, через середину которой выводится анодный токоподвод. для предохранения пробки от обгорания и разрушения снизу к ней крепится фторопластовая прокладка. Наверху у кварцевой диафрагмы имеется отводная трубка, через которую хлор из анодного пространства отсасывается водоструйным насосом. для поглощения хлора используют систему барботеров с раствором щелочи. В ячейку вставляется также платино - платинородиевая термопара 2 в кварцевом чехле. Сверху ячейка закрывается общей крышкой 6 из температуростойкого материала (шамота, асбеста). Постоянный ток к электродам ячейки подается с регулируемого выпрямителя. Требуемую температуру в печи можно поддерживать вручную, используя автотрансформатор, или автоматически посредством электронного потенциометра
Рисунок 1. Электролитическая ячейка для получения магния.
Преподаватель перед началом работы сообщает общую массу загружаемой навески солей в ячейку, химический состав навески и процентное содержание в ней отдельных компонентов, силу тока при электролизе магния и продолжительность опыта. Вначале в ячейку загружают необходимую навеску смеси хлоридов натрия и калия и печь включают на разогрев. После расплавления солей и достижения заданной температуры, при которой будет проводиться электролиз, в расплав осторожно всыпают навеску обезвоженного хлорида магния (или карналлита) и фторида натрия (NaF вводится в расплав из расчета 1,5 % мас. от массы электролита). Затем в расплав опускают кварцевую диафрагму с подсушенным анодом. Тщательно очищенный и взвешенный катод опускают в электролит при небольшой силе тока н сразу же посредством ручки на выпрямителе устанавливают требуемую силу тока электролиза. Это делается для того, чтобы поверхность катода при опускании в расплав не успела окислиться. Термопару в кварцевом чехле надо опустить в стакан в начале опыта. В начале и в конце электролиза измеряют обратную ЭДС и берут пробы электролита в кварцевую трубку, опускаемую в расплав на 1-2 с. Электролит анализируют на содержание в нем MgC12 и MgO. В течение опыта следят за постоянством силы тока электролиза и через каждые 15 мин фиксируют напряжение на ячейке. Кроме того, записывают силу тока и напряжение переменного тока, идущего на нагревательные элементы печи. Определяют общее время работы печи (нагревателей) за время электролиза. По окончании опыта (выключения выпрямителя) вынимают катод с выделившимся магнием и анод с кварцевой трубкой. Магний, отставший от катода и плавающий на поверхности расплава, вычерпывают подогретой дырчатой ложкой и переносят в стальной тигель. По извлечении магния из электролита выключают печь и расплав выливают в подогретый стальной сосуд. В конце работы определяют общее количество полученного магния.
Расчеты
Электрохимический эквивалент магния КMg КMg = где М - молекулярная масса магния ; z - валентность; F - число Фарадея.
Масса теоретическая Pm = KMg ∙ I ∙ t, где I - сила тока, А; t - время, ч. Pm = 0,453 ∙ 9 ∙ 0,67 = 2,73 г Масса практическая Рпр = 1,68 г Выход по току:
Удельный расход электроэнергии
где U- напряжение на ячейке, В
Выход по энергии
где Wт - теоретический удельный расход электроэнергии
где Е - обратная ЭДС, В;
Удельный расход Mg Cl2: MgCl2 → Mg + Cl2 95,3 - 24,3 X - 1
Расчетные и измеренные данные заносим в таблицу 1:
Таблица 1. Расчетные и измеренные значения электролитического получения магния
Вывод: Выход по току составляет 61,5 %, что намного ниже обычного. Это можно объяснить несколькими причинами: не весь полученный металл был собран с катода, возможно произошла частичная пассивация катода, работа велась на уже не раз использованном электролите, температура электролиза была выше нормы, также могли быть механические потери при составе электролита. Все эти факторы способствовали снижению выхода по току магния.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
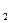 О), но может быть также использован и бишофит (MgCI2 ∙ 6Н
О), но может быть также использован и бишофит (MgCI2 ∙ 6Н 
 Mg + С12
Mg + С12
 Mg E1 =-2,111 В; (1)
Mg E1 =-2,111 В; (1)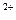 + 2е
+ 2е 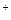 и незначительная активность ионов Мg в расплаве KCl – NаСl – МgСl
и незначительная активность ионов Мg в расплаве KCl – NаСl – МgСl  - 2е → 2С12
- 2е → 2С12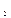 в электролите рекомендуется поддерживать концентрацию MgC12 в интервале 10-20 % мас.
в электролите рекомендуется поддерживать концентрацию MgC12 в интервале 10-20 % мас. С) приводит к быстрому снижению выхода по току вследствие более интенсивного окисления магния хлором, кислородом и влагой, а также уменьшения разницы между плотностями электролита и магния.
С) приводит к быстрому снижению выхода по току вследствие более интенсивного окисления магния хлором, кислородом и влагой, а также уменьшения разницы между плотностями электролита и магния. довольно сильно влияет на вы
довольно сильно влияет на вы + 3Mg = 4MgO + S
+ 3Mg = 4MgO + S и выдерживают несколько часов. Затем прекращают барботирование через расплав газа и, закрыв стакан крышкой, расплав медленно охлаждают. Наиболее чистый и обезвоженный продукт получается в средней части застывшей соли. Хранят безводный карналлит или хлорид магния в герметичной таре, т.к. они сильно поглощают влагу из воздуха.
и выдерживают несколько часов. Затем прекращают барботирование через расплав газа и, закрыв стакан крышкой, расплав медленно охлаждают. Наиболее чистый и обезвоженный продукт получается в средней части застывшей соли. Хранят безводный карналлит или хлорид магния в герметичной таре, т.к. они сильно поглощают влагу из воздуха.
 ;
;

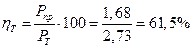

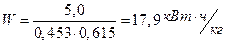
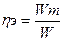




 кг/кг Mg
кг/кг Mg