
|
|
Способы обнаружения точки эквивалентности12 Индикаторы. Для фиксирования конца титрования используют визуальные (титрование индикатором, цветным или флуоресцентным) и инструментальные методы (потенциометрическое, амперометрическое, фотометрическое титрование). Цветные индикаторы и кислотно-основном титрование - это слабые органические кислоты и основания, протонированные и непротонированные формы которых различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двухцветные (например, метиловый оранжевый) индикаторы. Изменение окраски индикатора связано с таутомерией органических молекул, содержащих хромофор. Такие соединения обладают подвижными π-электронами, и в зависимости от распределения электронной плотности молекуле можно приписать несколько структур; предельные структуры называются таутомерами. на распределение электронной плотности влияет наличие ауксохромных групп(например, NH2 , OH- и т.п.). Ауксохромы связаны с ненасыщенным углеродным скелетом хромофора так, что положение двойных связей изменяется. Разность энергий основного и возбужденного ( под действием света) состояний таких веществ мала, поэтому молекула поглощает свет в видимой части спектра, и вещество имеет определенную окраску. Например, метиловый оранжевый в щелочной среде окрашен в желтый цвет (хромофор -N=N-). В кислой среде азот, содержащий неподеленную пару электронов, протонируется, при этом образуется сопряженная система таутомеров Цепь сопряжения в таутомере II, а следовательно, и подвижность π-электронов увеличивается, в результате энергия возбуждения молекулы уменьшается и свет поглощается в красной области сектора. Метиловый оранжевый - двухцветный индикатор. Он относится к классу азоиндикаторов, имеющих в кислой среде красную, а в щелочной среде желтую окраску. Сюда относятся также метиловый красный Однако существуют соединения, не содержащие хромофоров, у которых под влиянием среды структура изменяется так, что появляются хромофорные группы. Таковы фталеины. Например, фенолфталеин в кислой среде бесцветен. В щелочной среде в результате перераспределения электронной плотности в его молекуле образуется хиноидная структура (хромофор), находящаяся в равновесии со своей таутомерной формой. Вещество приобретает красную окраску. Группу индикаторов, схожую с фталеинами, составляет сульфофталеины: бромкрезоловый зеленый, феноловый красный, тимоловый синий и другие соединения. Например, в растворе фенолового красного в равновесии находятся красная и желтая формы. Отдельную группу составляют трифенилметановые красители: кристаллический фиолетовый, метиловый фиолетовый, малахитовый зеленый и др.Известно большое число разных кислотно-основных индикаторов, сведения о которых есть в литературе. Схематически (опуская промежуточные формы) равновесие в растворе индикатора можно представить как кислотно-основную реакцию HIn+H2O = In- +H3O+ Из константы кислотности индикатора, пренебрегая влиянием ионной силы и побочными взаимодействиями, получаем
Человеческий глаз воспринимает окраску одной из форм при определенной концентрации ее в растворе. Для двухцветного индикатора присутствие одной из форм заметно, если концентрация ее в несколько раз превышает концентрацию другой формы. Пусть глаз замечает форму In- при
Очевидно, что, если глаз улавливает окраску одной из форм на фоне другой при большем или меньшем соотношении, ΔрН будет другим. Чем меньше интервал , тем ценнее индикатор. Для одноцветных индикаторов при изменении рН нарастает или уменьшается концентрация окрашенной формы. При определенной концентрации глаз замечает появление или исчезновение окраски. Пусть окрашенная форма In-. Тогда рН, при котором появляется окраска, можно выразить так:
Как видно, рН появления окраски зависит от концентрации индикатора в растворе. К индикаторам предъявляют ряд требований: 1.Индикатор должен обладать высоким светопоглащением так, чтобы окраска даже его небольшого количества была заметна для глаза. Большая концентрация индикатора может привести к расходу на него титранта. 2.Переход окраски должен быть контрастным. 3.Область перехода окраски должна быть как можно уже. Середина области перехода окраски индикатора (при этом Для сужения области перехода окраски и увеличения контрастности применяют смешанные индикаторы, которые составляют из индикатора и красителя. при определенном значении рН цвет красителя является дополнительным к цвету индикатора - в результате в этой точке окраска будет серой, а переход от окрашенного раствора к серому - контрастным. На область перехода окраски индикатора (положение и интервал) влияет все факторы, от которых зависит константа равновесия (ионная сила, температура, посторонние вещества, растворитель), а также концентрация индикатора. Погрешности титрования. При титровании возможны случайные и систематические погрешности (ПТ). Случайные погрешности связаны с измерением объема и массы навески, систематические- с несовпадением ТЭ и конца титрования. Случайные погрешности обрабатывается по законом математической статистики. Они тем меньше, чем больше индекс крутизной кривой титрования, поскольку стандартное отклонение объема титранта St связано с крутизной соотношением
где s(V) - стандартное отклонение объема в конечной точке титрования. Индекс крутизны при титровании слабых электролитов меньше, чем при титровании сильных, поэтому случайные погрешности в последнем случае имеют меньшие значения. Систематические погрешности могут быть положительными (перетитровывание) и отрицательными (недотитровывание). Для оценки систематической погрешности можно воспользоваться графическим и расчетным способами. Графический способ является лишь ориентировочным. Опустим перпендикуляр из точки с ординатой рТ на ось абсцисс. Отрезок между полученным значением f и f в ТЭ и есть погрешность титрования. При расчетном способе погрешность вычисляют, используя формулы (4)-(17), связывающие рН и f. При недотитровывании ПТ= - (1-f), при перетитровывании ПТ= f -1. При титровании сильных кислот, для которых
а с учетом изменения объема
При титровании сильных оснований
а с учетом изменения объема
При перетитровывание ПТ рассчитывают по аналогичным формулам, но изменяет знак. При титровании слабых кислот относительная погрешность титрования ПТ=f -1. Учитывая, что
получаем
При титровании слабого основания
При перетитровываниии (т.е. при избытке сильной кислоты или основания) пригодны формулы (24)и (26). 2.6.Вычисление индикаторной погрешности титрования: Феноловый красный рT = 7,3
В ТЭ получается раствор формиата натрия. Эта соль подвергается гидролизу: CH3COO- + H20 = СН3СООН+ OH-. Поэтому оттитрованный раствор имеет слабощелочную реакцию, pH в ТЭ можно вычислить по уравнению:
Для уксусной кислоты pK=4,76. Концентрация в конце титрования составляет приблизительно 0,005 н. Следовательно
Из этого расчета видно, что для титрования нужно взять слабый индикатор титрования, равным 7,7 или близким к этому значению. Наиболее подходящим индикатором является феноловый красный, так как pT = 7,3. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

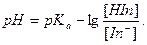 (22)
(22) и форму HIn при
и форму HIn при  . Тогда в интервале рН от
. Тогда в интервале рН от 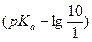 до
до  глаз будет видеть смешанную окраску обеих форм, а за пределами этого интервала – чистую окраску одной из форм. Этот интервал называют интервалом перехода окраски индикатора:
глаз будет видеть смешанную окраску обеих форм, а за пределами этого интервала – чистую окраску одной из форм. Этот интервал называют интервалом перехода окраски индикатора: (23)
(23) .
. ) называется показателем индикатора (рТ) и фактически отождествляется с конечной точкой титрования. Выбирают индикатор для титрования так, чтобы область перехода входила в скачок титрования. Границы скачка титрования определяются заданной точностью. Чем жестче требования к точности титрования, тем уже скачок, тем более ограничен выбор индикатора.
) называется показателем индикатора (рТ) и фактически отождествляется с конечной точкой титрования. Выбирают индикатор для титрования так, чтобы область перехода входила в скачок титрования. Границы скачка титрования определяются заданной точностью. Чем жестче требования к точности титрования, тем уже скачок, тем более ограничен выбор индикатора.

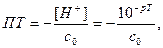 (24)
(24)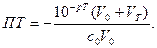 (25)
(25) (26)
(26) (27)
(27)

 (28)
(28) (29)
(29) или -0,5%
или -0,5% .
.