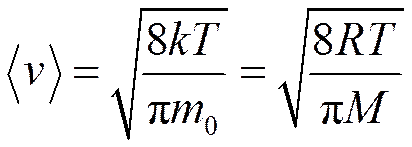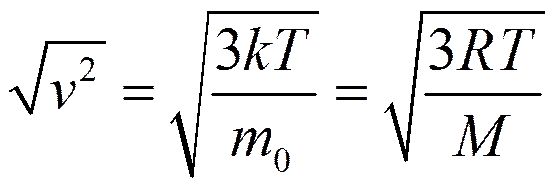|
|
Статистические распределенияИ ТЕРМОДИНАМИКИ Два подхода различны, но взаимно дополняют друг друга. Молекулярная (статистическая) физика использует математический аппарат теории вероятностей и представляет процессы, происходящие в телах как результат осредненного движения атомов и молекул. Термодинамика основана на общих принципах (началах),которые являются обобщением опытных фактов и используются для описания состояния термодинамической системы в условиях равновесия и процессов перехода из одного состояния в другое. Молекулярно-кинетическая теория идеальных газов (мкт) Основное уравнение молекулярно-кинетической теории идеальных газов В молекулярно-кинетической теории (МКТ) используют модель идеального газа, которая удовлетворяет следующим условиям: собственный объем молекул газа мал по сравнению с занимаемым этим газом объемом (молекулы –материальные точки); между молекулами газа отсутствуют силы взаимодействия; столкновения молекул газа между собой и со стенками абсолютно упругие. Основное уравнение МКТ связывает параметры состояния газа: давление Р, объем V и абсолютную температуру Т с осредненными характеристиками движения его молекул, т. е. со средней квадратичной скоростью Для вывода основного уравнения МКТ рассмотрим одноатомный идеальный газ, молекулы которого движутся с постоянной скоростью
Выделим на стенке сосуда элементарную площадку Ds и рассчитаем давление, которое оказывает на нее идеальный газ. При каждом соударении молекула массой mо передает стенке импульс
За время
в любой момент времени вдоль оси x движется 1/3 всех молекул (1/3 N), находящихся в объеме выделенного цилиндра, а к рассматриваемой площадке – 1/6 N, так как два направления равновероятны. Следовательно, о площадку
По второму закону Ньютона
Давление Р, оказываемое на площадку, определится как
При выводе уравнения предполагалось, что скорости молекул одинаковы, однако, они двигаются с разными скоростями v1, v2, ... vn. Таким образом, всю совокупность молекул N характеризует средняя квадратичная скорость
С учетом этого давление
или
основное уравнение МКТ. Связь термодинамической характеристики газа, его температуры T, с осредненной кинетической энергией теплового движения молекул
где k – постоянная Больцмана, равная При Т = 0 средняя кинетическая энергия теплового движения молекул Из основного уравнения МКТ следует, что т. е. давление идеального газа прямо пропорционально концентрации его молекул и температуре газа.
Уравнение состояния идеального газа (Клапейрона – Менделеева) Опыт показывает, что в состоянии термодинамического равновесия давление газа Р, его объем V и температура Т находятся в функциональной зависимости не только для идеальных, но и для реальных газов, которая может быть выражена уравнением
Уравнение называется уравнением состояния. Вид уравнения получен путем обобщения опытных данных, которые известны как закон Бойля – Мариотта
закон Гей – Люссака
закон Шарля
Таким образом, для одного моля газа связь параметров состояния имеет вид
где Для любой массы газа уравнение состояния имеет вид
где Уравнение называется уравнением Клапейрона – Менделеева. Статистические распределения При термодинамическом равновесии в любой макроскопической системе Распределение молекул газа по скоростям (закон Максвелла) В результате теплового движения молекул в газе, находящемся в состоянии теплового равновесия, устанавливается некоторое стационарное (постоянное) распределение молекул по скоростям.
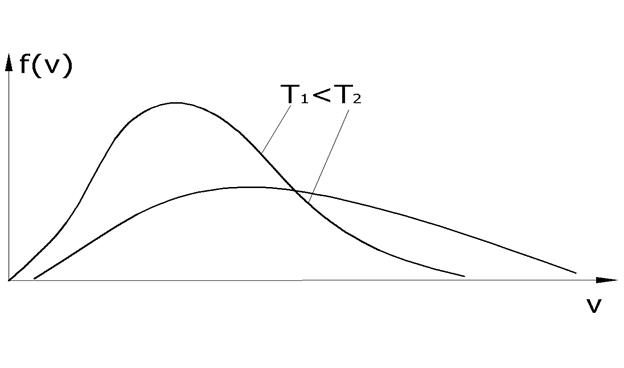
Если отложить на оси ординат функцию распределения Функция распределения Максвелла
Таким образом, площадь Вид функции распределения молекул по скоростям
Конкретный вид функции зависит от массы молекул и температуры газа. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице, т. е. функция распределения
а это есть численное значение площади под кривой. Скорость, при которой функция распределения имеет максимум, называется наиболее вероятной скоростью. Значение
наибольшее число молекул имеет наиболее вероятную скорость В МКТ пользуются также понятием среднеарифметической скорости
скорости молекул зависят от температуры. При повышении температуры максимум функции распределения смещается вправо, но площадь под кривой численно равна 1. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 и средней кинетической энергией молекул
и средней кинетической энергией молекул  .
.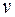 , а число столкновений между ними малό по сравнению с числом ударов о стенки сосуда (столкновения абсолютно упругие). Хаотическое движение молекул, для которых равновероятны все направления, заменим движением вдоль трех взаимно-перпендикулярных осей x, y, z.
, а число столкновений между ними малό по сравнению с числом ударов о стенки сосуда (столкновения абсолютно упругие). Хаотическое движение молекул, для которых равновероятны все направления, заменим движением вдоль трех взаимно-перпендикулярных осей x, y, z.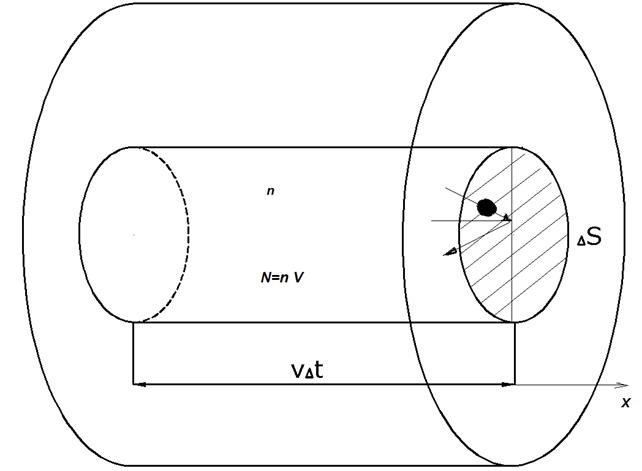

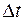 выделенной площадки
выделенной площадки 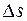 могут достигнуть только те молекулы, которые заключены в объеме цилиндра с основанием
могут достигнуть только те молекулы, которые заключены в объеме цилиндра с основанием 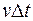 . Если принять, что n – концентрация молекул, т. е. количество молекул в единице объема, то общее число молекул, находящихся в объеме цилиндра, можно представить как
. Если принять, что n – концентрация молекул, т. е. количество молекул в единице объема, то общее число молекул, находящихся в объеме цилиндра, можно представить как
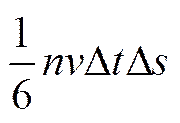 молекул, которые передадут ей импульс
молекул, которые передадут ей импульс 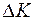
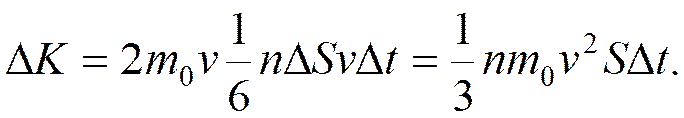 .
.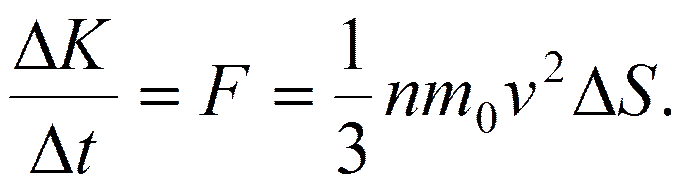 .
.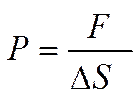
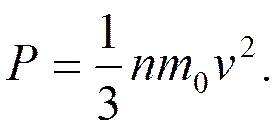
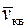 , которая определяется как
, которая определяется как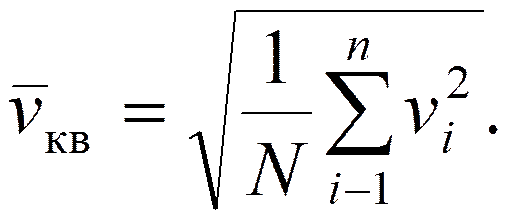 .
.

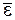 была установлена Больцманом и имеет вид
была установлена Больцманом и имеет вид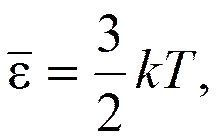
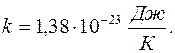
 , т. е. должно прекратиться тепловое движение молекул.
, т. е. должно прекратиться тепловое движение молекул.
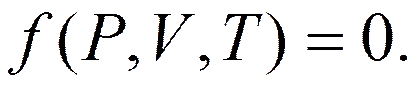
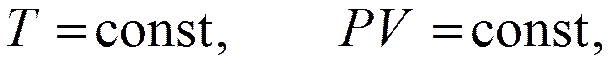



 – объем одного моля газа, который согласно закону Авогадро одинаков для всех газов при одинаковой температуре и давлении; R – универсальная газовая постоянная, равная
– объем одного моля газа, который согласно закону Авогадро одинаков для всех газов при одинаковой температуре и давлении; R – универсальная газовая постоянная, равная 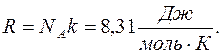
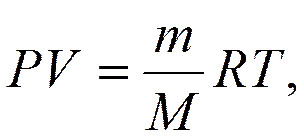
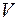 – объем, который занимает весь газ;
– объем, который занимает весь газ; 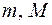 – соответственно масса и молекулярная масса газа;
– соответственно масса и молекулярная масса газа; 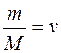 – число молей газа.
– число молей газа. статистические распределения физических величин имеют универсальный вид, установленный Гиббсом. Частными случаями распределения Гиббса являются распределения молекул идеального газа по скоростям (закон Максвелла) и распределение положения молекул в потенциальном поле (распределение Больцмана).
статистические распределения физических величин имеют универсальный вид, установленный Гиббсом. Частными случаями распределения Гиббса являются распределения молекул идеального газа по скоростям (закон Максвелла) и распределение положения молекул в потенциальном поле (распределение Больцмана).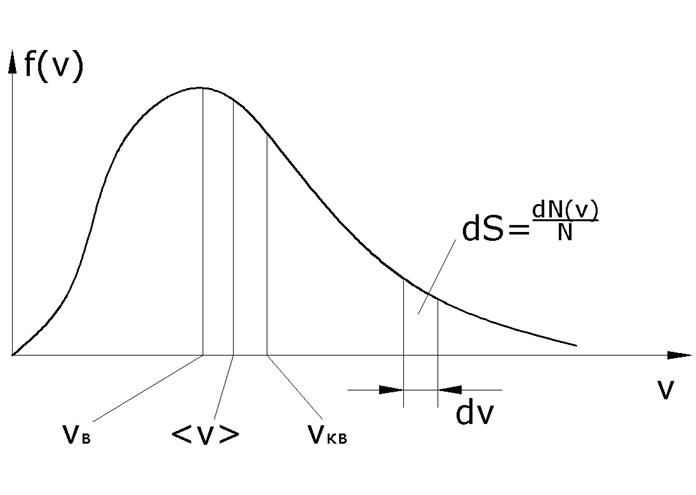
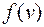 , а на оси абсцисс скорости молекул
, а на оси абсцисс скорости молекул  на малые интервалы
на малые интервалы 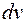 , то на каждый интервал
, то на каждый интервал 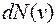 , имеющих скорость, заключенную в данном интервале.
, имеющих скорость, заключенную в данном интервале.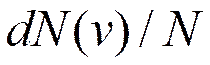 , скорости которых заключены в интервале от v до
, скорости которых заключены в интервале от v до 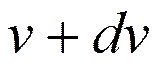 , т. е.
, т. е.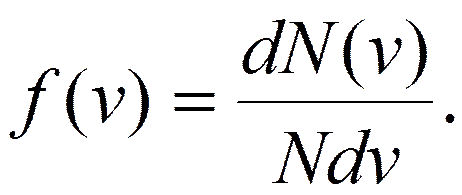
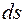 на рис. определяет относительное количество молекул, скорости которых лежат в интервале от v до
на рис. определяет относительное количество молекул, скорости которых лежат в интервале от v до 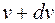 .
.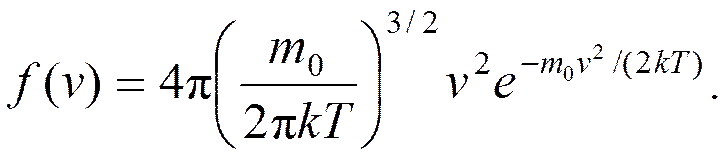

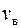 можно вычислить, приравняв производную
можно вычислить, приравняв производную 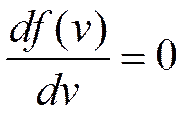
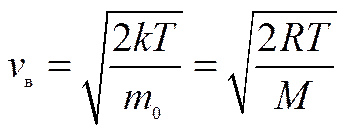
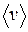 , которая также вычисляется из закона распределения Максвелла
, которая также вычисляется из закона распределения Максвелла