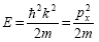|
|
Недостатки теории Бора. Волновая функция и ее свойства. Уравнение ШредингераДискретность энергетических уровней в атоме. Опыты Франка и Герца Успехи теории Бора в объяснении спектральных закономерностей в изучении атома водорода были поразительны. Стало ясно, что атомы – это квантовые системы. Энергетические уровни стационарных состояний атомов дискретны. Почти одновременно с созданием теории Бора было получено прямое экспериментальное доказательство существования стационарных состояний атома и квантования энергии - дискретность энергетических состояний атома была продемонстрирована в опыте Д. Франка и Г. Герца (1913 г.), в котором исследовалось столкновение электронов с атомами ртути методом задерживающего потенциала. Электроны, эмитированные катодом K , разгоняются в области 1 под действием ускоряющей разности потенциалов ϕ между катодом и сеткой C1 (рис. 34.6).
Согласно боровской концепции, при обратном самопроизвольном переходе атома ртуть должна испускать кванты с частотой Спектральная линия с такой частотой действительно была обнаружена в ультрафиолетовой части спектра в излучении атомов ртути. Представление о дискретных состояниях противоречит классической физике. Поэтому возник вопрос, не опровергает ли квантовая теория законы классической физики. Квантовая физика не отменила фундаментальных классических законов сохранения энергии, импульса, электрического разряда и т. д. Согласно сформулированному Н. Бором принципу соответствия, квантовая физика включает в себя законы классической физики, и при определенных условиях можно обнаружить плавный переход от квантовых представлений к классическим. Это можно видеть на примере энергетического спектра атома водорода (рис. 34.8). При больших квантовых числах n >> 1 дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, характерного для классической физики. Недостатки теории Бора. Волновая функция и ее свойства. Уравнение Шредингера Однако в теории Бора существовали недостатки: 1) трудность объяснения спектральных закономерностей сложных атомов и молекул; 2) проблемы при создании физич. теории хим. реакций; 3) непоследовательность теории в целом, т.к. введенное правило квантования момента импульса (ф. (34.3) в принципе несовместимо с классическим поведением электрона, что проявилось после введения гипотезы де Бройля (каждой частице соответствует длина волны λ =h/ p).
получаем правило квантования: 2πr = nλ(34.10) , т.е. на длине 2πr электронной орбиты должно укладываться целое число волн де Бройля, что является условием существования волновой функции Ψв виде стоячей волны. Таким образом, представление Бора об определенных орбитах, по которым движутся электроны в атоме, оказалось весьма условным. На самом деле движение электрона в атоме очень мало похоже на движение планет или спутников. Интенсивность волн де Бройля в данной точке пространства связана с числом частиц, попавших в эту точку, о чем свидетельствуют опыты по дифракции микрочастиц. Поэтому волновые свойства микрочастиц требует статистического (вероятностного) подхода к их описанию. Для описания поведения квантовых систем вводится волновая функция Ψ (x, y, z, t). Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции |Ψ|2. Волновая функция Ψ определяется таким образом, чтобы вероятность dw того, что частица находится в элементе объема dV была равна: Волновая функция должна быть: 1) конечной (вероятность не может быть больше единицы), 2) однозначной (вероятность не может быть неоднозначной величиной) и 3) непрерывной (вероятность не может изменяться скачком). Волновая функция удовлетворяет принципу суперпозиции:если система может находиться в различных состояниях, описываемых волновыми функциями Ψ1, Ψ2 ,…,Ψn ,…, то она также может находиться в состоянии, описываемом линейной комбинацией этих функций (где Cn (n =1, 2,…)— произвольные, вообще говоря, комплексные числа):
Волновая функция Ψ является решением основного уравнения квантовой механики – уравнения Шредингера: Важным частным случаем общего уравнения Шредингера, является уравнение Шредингера для стационарных состояний, в котором исключена зависимость Ψот времени и, поэтому, значения энергии этих состояний являются фиксированными(не изменяются со временем). В этом случае силовое поле, в котором движется частица, стационарно, т.е. функция U =U(x, y, z) не зависит явно от времени и имеет смысл потенциальной энергии. Решение уравнения может быть представлено в виде произведения двух функций — функции только координат и функции только времени:
(34.15)
после упрощений приобретает вид: — уравнение Шредингера для стационарных состояний. Физический смысл имеют только регулярные волновые функции — конечные, однозначные и непрерывные вместе со своими первыми производными. Эти условия выполняются только при определенном наборе E . Эти значения энергии называются собственными. Решения, которые соответствуют собственным значениям энергии, называются собственными функциями. Собственные значения E могут образовывать как непрерывный, так и дискретный ряд. В первом случае говорят о непрерывном(или сплошном) спектре, во втором — о дискретном спектре. Рассмотрим движение свободной частицы: Для свободной частицы U(x) = 0 (пусть она движется вдоль оси x ). Решение уравнения Шредингера:
(34.18), непрерывный спектр энергий. Таким образом, свободная квантовая частица описывается плоской монохроматической волной де Бройля. Этому соответствует не зависящая от времени плотность вероятности обнаружения частицы в данной точке пространства |Ψ|2 = ΨΨ* = A2 , т.е. все положения свободной частицы в пространстве являются равновероятными. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 В области 2 электроны проходят через пары ртути и достигают анода A. Первое возбужденное состояние атома ртути имеет энергию 4,86 эВ. Оказалось, что если энергия электронов меньше 4,86 эВ, то их столкновение с атомами ртути происходит по закону абсолютно упругого удара. При увеличении ускоряющего потенциала φ до этой величины, соударения электронов с атомами становятся неупругими: электрон отдает кинетическую энергию атому, возбуждая переход из основного энергетического состояния в первое возбужденное состояние (поглощение энергии атомами ртути) — ток в установке резко уменьшается (рис. 34.7).
В области 2 электроны проходят через пары ртути и достигают анода A. Первое возбужденное состояние атома ртути имеет энергию 4,86 эВ. Оказалось, что если энергия электронов меньше 4,86 эВ, то их столкновение с атомами ртути происходит по закону абсолютно упругого удара. При увеличении ускоряющего потенциала φ до этой величины, соударения электронов с атомами становятся неупругими: электрон отдает кинетическую энергию атому, возбуждая переход из основного энергетического состояния в первое возбужденное состояние (поглощение энергии атомами ртути) — ток в установке резко уменьшается (рис. 34.7). При дальнейшем увеличении Δφ, подобное же поведение тока наблюдается при энергиях, кратных ΔE =4,86 эВ, когда электроны испытывают 2, 3, … неупругих соударений. → В атоме действительно существуют стационарные состояния (подтверждение первого постулата Бора). Возбужденные атомы ртути, переходя в основное состояние, излучают кванты света с длиной волны λ = hc /ΔE = 255нм (подтверждение второго постулата Бора).
При дальнейшем увеличении Δφ, подобное же поведение тока наблюдается при энергиях, кратных ΔE =4,86 эВ, когда электроны испытывают 2, 3, … неупругих соударений. → В атоме действительно существуют стационарные состояния (подтверждение первого постулата Бора). Возбужденные атомы ртути, переходя в основное состояние, излучают кванты света с длиной волны λ = hc /ΔE = 255нм (подтверждение второго постулата Бора).
 Выражая скорость в ф. (34.3) с помощью длины волны,
Выражая скорость в ф. (34.3) с помощью длины волны, (34.11)
(34.11) (34.12)
(34.12) (34.13), где
(34.13), где 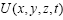 - потенциальная функция частицы в силовом поле, Ψ (x, y, z, t)— искомая волновая функция частицы.
- потенциальная функция частицы в силовом поле, Ψ (x, y, z, t)— искомая волновая функция частицы. (34.14), где E — полная энергия частицы. Уравнение Шредингера:
(34.14), где E — полная энергия частицы. Уравнение Шредингера:
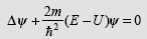 (34.16)
(34.16) - функция
- функция  (34.17), где
(34.17), где — волновое число — может принимать любые положительные значения,
— волновое число — может принимать любые положительные значения,