
|
|
Понятие газа Ван-дер-ВаальсаИсследование состояния газа Ван-дер-Ваальса
Методические указания к выполнению лабораторной работы
ЕТИ.ФХ. 02
Егорьевск 2005
Составители: профессор, д.х.н. Нилов А.П. ст.преп. Никифоров В.Ю. Рецензент доцент к.ф-м.н. Бурмистров А.В.
* В методических указаниях рассмотрено понятия идеального, физического газов и газа Ван-дер-Ваальса, агрегатных состояний, фазовых переходов и тройной точки, рассмотрены кривые давления насыщенного пара жидкостей и твердых веществ, а так же рассмотрены компьютерная модель, описывающей вещество в газообразном состоянии и его переход в жидкое состояние, и экспериментальное подтверждение закономерностей поведения «реального газа» (газа Ван-дер-Ваальса) с использованием компьютерной программы ООО «Физикон» «Открытая физика 1.1» версия «Виртуальный практикум по физике для ВУЗов». В основе данных методических указаний лежит учебное пособие «Тихомиров Ю.В. Лабораторные работы по курсу физики с компьютерными моделями (Молекулярная физика и термодинамика). Учебное пособие для студентов высших технических учебных заведений дневной, вечерней и заочной (дистанционной) форм обучения. -М.:2003.-22 с.» Методические указания предназначены для студентов 2 вузовского курса, обучающихся по специальности 330200 по дисциплине «Физическая химия». .
Методические указания обсуждены на заседании кафедры естественно-научных дисциплин. Протокол № от
Заведующий кафедрой А.П. Нилов
Методические указания рассмотрены и одобрены методическим советом института Протокол № от
Председатель совета А.Д.Семенов
Исследование состояния газа Ван-дер-Ваальса
1. Цель работы: * Знакомство с компьютерной моделью, описывающей вещество в газообразном состоянии и его переход в жидкое состояние. * Экспериментальное подтверждение закономерностей поведения «реального газа» (газа Ван-дер-Ваальса). 2 Оборудование и материалы: компьютерный класс, пакеты прикладных программ для поддержки лабораторного практикума компании ООО «ФИЗИКОН»: «Виртуальный практикум для ВУЗов» или «Открытая Физика» версия 2.5 часть 1. Содержание работы. 3.1 Изучить теоретический материал. 3.2 Определить графически критическую изотерму и значения критических параметров ТКР, VКР, pКР . 3.3 Провести испытания по изучению изотерм газа Ван-дер-Ваальса для заданной температуры Т1 и заполнить таблицу аналогичную таблице 2 методических указаний. 3.4 Установив новое значение температуры Т из таблицы 1, задавая Vнач = 0.1 дм3, повторите измерения, записывая результаты в таблицы 3,4,5. 3.5 По измеренным значениям критических параметров вычислите константу А = 3.6 Построить графики по данным таблиц. 3.7 Для каждой изотермы определить значение количества вещества, вычислить среднее значение n и величину константы А’ 3.8 Оформить отчет.
4 Теоретические предпосылки работы Понятие газа Ван-дер-Ваальса Физическим газом называется вещество, находящееся в газообразном состоянии. «Идеальный газ» это название модели, описывающей физический газ, находящийся в сильно разреженном состоянии (при не слишком больших давлениях и достаточно высоких температурах). Уравнением, связывающим параметры состояния идеального газа, является уравнение Менделеева-Клапейрона. Поэтому оно имеет второе название: уравнение состояния идеального газа. Его вид известен: pV = nRT, (1) где p - давление газа, V - объем газа, n - количество киломолей, R - универсальная газовая постоянная, T - температура газа. Более точная модель физического (реального) газа была предложена Ван-дер-Ваальсом. Она также является приближенной, но лучше описывает процессы, нежели модель «идеальный газ». Иногда эту модель называют «реальный газ». Газом Ван-дер-Ваальса (ВдВ) называется воображаемый газ (модель), параметры состояния которого точно подчиняются уравнению
Оно называется УРАВНЕНИЕМ ВАН-ДЕР-ВААЛЬСА. Здесь a и b - константы Ван-дер-Ваальса. Добавка к внешнему давлению(а) обусловлена взаимным притяжением молекул друг к другу. Поправка к объему(b) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в газе. Изотермой называется зависимость давления от объема данного (фиксированного) количества вещества при постоянной температуре.
На рисунке 1 приведены изотермы некоторого физического (реального) газа, а на рисунке 2 и рисунке 3 - изотермы ВдВ газа (взяты из учебника [1] ).
Изотерма ВдВ газа, имеющая только точку перегиба и не имеющая экстремумов, называется критической. Температура критической изотермы называется критической температурой. Объем и давление в критической точке также называются критическими. УРАВНЕНИЯ ДЛЯ КРИТИЧЕСКИХ ПАРАМЕТРОВ: VКР = 3bν, pКР = Отсюда А =
При температуре выше критической вещество может находиться только в газообразном состоянии. При температуре ниже критической вещество может находиться как в газообразном, так и в жидком состоянии. Жидкое состояние описывается левыми (по отношению к точке перегиба на графике) частями графиков на рисунках и характерно тем, что небольшое уменьшение объема вещества может произойти только при резком увеличении давления (жидкость практически несжимаема). Изотермы ВдВ примерно совпадают с изотермами реального газа на участках, соответствующих однофазным состояниям вещества. Рисунок 3 разъясняет поведение вещества при разных внешних условиях. В области, где присутствуют 2 фазы (1-2-3-4) S-образный завиток изотермы ВдВ заменяется горизонтальным участком (1-4) реальной изотермы (см.учебник). НЕРЕАЛИЗУЕМОЕ СОСТОЯНИЕ соответствует участку 2-3, на котором сжимаемость ПЕРЕОХЛАЖДЕННЫЙ ПАР на участке 3-4 реализуется при определенных условиях (при практическом отсутствии центров конденсации и внешних воздействий). ПЕРЕГРЕТАЯ ЖИДКОСТЬ на участке 1-2 реализуется при отсутствии примесей, способных быть центрами кипения.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
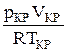 .
.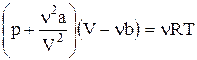 . (2)
. (2) Рисунок 1
Рисунок 1
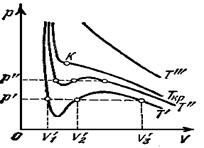 Рисунок 2
Рисунок 2
 Рисунок 3
Рисунок 3
 , TКР =
, TКР =  ,
,  ,
,  .
. n = 0,375n. (3)
n = 0,375n. (3) вещества была бы отрицательна, что невозможно.
вещества была бы отрицательна, что невозможно.