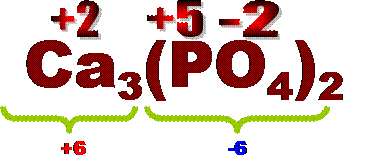|
|
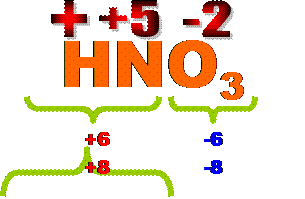
б) соли кислородсодержащих кислот (средние)А) бескислородные кислоты Расчет валентности неметалла в таких кислотах как в других бинарных соединениях ( см. выше). Б) кислородсодержащие кислоты ( кроме азотной) Эти соединения состоят из 3 элементов: водорода, кислорода и центрального атома ( в школьном курсе проходят кислоты с 1 центральным элементом). Задача - определить валентность центрального атома. Действия: Умножить 2(валентность кислорода) на число атомов кислорода. Из полученного произведения вычесть число атомов водорода. Значение разности и есть значение валентности центрального атома. Примеры: а) H2SO4 –серная кислота. Валентность серы=2(валентность кислорода) ´4(число атомов кислорода) – 2(число атомов водорода)=8-2=6Þ валентность серы=6. б) H3РO4 –фосфорная кислота. Валентность фосфора=2(валентность кислорода) ´4(число атомов кислорода) – 3(число атомов водорода)=8-3=5Þ валентность фосфора =5. в) HClO3 –хлорноватистая кислота. Валентность хлора=2(валентность кислорода) ´3(число атомов кислорода) – 1(число атомов водорода)=6-1=5Þ валентность хлора=5. №3 Расчет валентности в солях А) соли бескислородных кислот Расчет как в других бинарных соединениях(см. таблицу валентностей). б) соли кислородсодержащих кислот (средние) Эти соединения состоят из 3 элементов: металла, центрального атома, кислорода. Действия: 1) Определим, какой кислоте Î кислотный остаток, Выпишем формулу кислоты, рассчитаем валентность центрального атома (см. выше), валентность "О"=2. 2) Определим общую валентность кислотного остатка, она численно = числу атомов водорода в кислоте. 3) Умножим валентность кислотного остатка на индекс кислотных остатков и полученное произведение разделим на индекс металла. Это и будет валентность металла. Примеры: а) Fe2(SO4)3 кислотный остаток Î серной кислоте Þ валентность серы в кислоте H2SO4 =6. Валентность кислотного остатка =2 ( число атомов водорода). Валентность железа= 2( валентность кислотного остатка)´3(число кислотных остатков):2(индекс железа)=6:2=3 – сульфат железа (III)
а) Al2(SO3)3 кислотный остаток Î сернистой кислоте Þ валентность серы в кислоте H2SO3 =2´3-2=6-2=4. Валентность кислотного остатка =2 ( число атомов водорода). Валентность алюминия = 2( валентность кислотного остатка)´3(число кислотных остатков):2(индекс алюминия)=6:2=3 – сульфит алюминия.
в) Сa(ClO4)2 кислотный остаток Î хлорной кислоте Þ валентность хлора в кислоте HClO4 =2´4-1=8-1=7. Валентность кислотного остатка =1 ( число атомов водорода). Валентность кальция= 1( валентность кислотного остатка)´2(число кислотных остатков):1(индекс кальция)=2:1=2 – перхлорат кальция
Расчет степени окисления в бинарных соединениях . Тут мы должны помнить, что степень окисления (СТОК) в отличие от валентности - величина абстрактная и рассчитывается чисто арифметически с учетом знака, показывающего смещение ē-пар.(Þ расчеты годятся и для соединений азота).
Арифметические расчеты такие же, как при определении валентности, только учитываем знак СТОК.(См. таблицу СТОК). Число зарядов катионов = числу зарядов анионов в нейтральной молекуле.
Расчет степени окисления в кислородсодержащих кислотах.
а) HClO4 - хлорная кислота. Пусть х – СТОК "CL" Þ имеем уравнение: 1´(+1) + х + 4´(-2) =0 Молекула электронейтральная и сумма зарядов анионов кислорода и катионов ( водорода и центрального атома) =0. 1+х-8=0 Þ х=7
б) H2SO4 - серная кислота. Пусть х – СТОК "S" Þ имеем уравнение: 2´(+1) + х + 4´(-2) =0 Þ СТОК "S" =+6
в) H3РO4 - фосфорная кислота. Пусть х – СТОК "Р" Þ имеем уравнение: 3´(+1) + х + 4´(-2) =0 Þ СТОК "Р" =+5
в) HNO3- азотная кислота. Пусть х – СТОК "N" Þ имеем уравнение: 1´(+1) + х + 3´(-2) =0 Þ СТОК "N" =+5
Расчет степени окисления в основаниях. В этих веществах СТОК катиона металла = числу ОН-групп, СТОК "О" = -2, а СТОК "Н" =+1.
Расчет степени окисления в средних солях кислородсодержащих кислот. В электронейтральной молекуле соли заряды катионов металла и анионов кислотных остатков численно=. Заряд аниона кислотного остатка численно = числу атомов водорода в соответствующей кислоте, только со знаком "-". а) Fe2(SO4)3 кислотный остаток Î серной кислоте Þ СТОК серы в кислоте H2SO4 =+6. СТОК кислотного остатка =-2 ( число атомов водорода). Пусть х – СТОК "Fe" , тогда имеем уравнение: 2(индекс Fe)´х + (-2)´3(число кислотных остатков)=0 Þ 2х-6=0 Þх=+3
Вывод формул по валентности бинарных соединений. №1 Ставим над элементами известные из таблицы или названия вещества значения валентности. Находим их наименьшее общее кратное. №2 Полученную величину делим на значения валентности. Это и будут искомые индексы. Пример:
Помни! Валентность - реальная величина, указывает число химических связей. Степень окисления- абстрактная величина, указывает лишь на смещение ē-пар и перераспределение зарядов в молекуле Þ валентность и СТОК в веществе могут разнится не только по знаку, но и по модулю. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|