
|
|
Диффузия в газах. Коэффициент диффузии?????????Закон Бойля-Мариотта, Шарля и Гей-Люссака Закон Бойля – Мариотта.Для данной массы газа при постоянной температуре произведение давления на объем остается величиной постоянной: PV= const. Процессы, происходящие при постоянной температуре, называются изотермическими, а кривые, изображающие процессы при Т=const, называются изотермами. Поскольку Р=С/V (С=const), изотермы являются гиперболами. Закон Гей-Люссака. Для данной массы газа при постоянном давлении объем изменяется при увеличении температуры по линейному закону: V=V0(1+at0C), где a=1/2730C подставив это значение, получим V=( V02730C+ t0C)/ 2730C, Введем абсолютную температуру Т=2730C+ t0C, откуда V/T= V0/2730C=const. Закон Гей-Люссака можно сформулировать следующим образом: отношение объема к абсолютной температуре для данной массы газа при постоянном давлении, называются изобарными, а кривые, изображающие изобарный процесс, изобарами. Закон Шарля. Для постоянной массы газа при постоянном объеме отношение давления газа к его температуре остается постоянным: P/T=const при m=const, V=const. Процессы, происходящие при постоянном объеме, называются изохорными, и кривые их изображающие изохорами. Уравнение, устанавливающие связь всех трех параметров при постоянной массе газа, называется объединенным газовым законом. Пусть система, находящаяся в состоянии 1, характеризуется параметрами Р1,V1,Т1, перешла в состояние 2, характеризующееся параметрами Р1,V1,Т1. Переведем систему из состояние 1 в 2 следующим образом: сначала газ изотермически расширяется до объема V2, а затем изохорно нагревается до температуры Т2. Итак, промежуточное состояние газа 1’ характеризуется параметрами Р’,V2,Т1. При изотермическом расширении справедливо выражение P1V1=P’V2 (закон Бойля – Мариотта) . При изохорном нагревании P’/T1=P2/T2 (закон Шарля). Выразив P’ и приравняв выражение для P’ получим (P1V1)/T1=(P2V2/T2), т.е. при m=const PV/T=const. 2. Статистический смысл абсолютной температуры и давление газа. На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: p = 1/3m0n Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. В шкале Кельвина за ноль принят абсолютный ноль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Вычисления дают результат, что абсолютный нуль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °C + 273. Абсолютный нуль температур недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т. е. прекращается тепловое движение молекул.
2. Средняя кинетическая энергия движения молекул. Внутреняя энергия идеального газа. Скорости газовых молекул Диффузия в газах. Коэффициент диффузии????????? Полное число молеул в единице объема будет равно n=åni. Относительной концентрацией i-й компоненты в смеси называется безразмерная величина Абсолютной концентрацией какой либо компонетны наз. масса молекул данного сорта, содержащаяся в единице объема. Если масса молекулы i-й компоенты miто абсолютная концентрация будет равна ci=nimi. Давление газовой смеси равно сумме парциальных давлений отдельных компонент и определяется полным числом молекул в единице объема p=åpi=ånikt=nkt. Может случиться что концентрация газовых компонентов в различных точках пространства будет не одинакова. В этом случае вследствие теплового движения молекул будет происходить процесс выравнивания концентраций, сопровождающийся переносом массы i-й компоненты в направлении убывания ее концентрации. Этот процесс носит наз. диффузии.Давление в процессе диффузии не изменяется. Происходит лишь перераспределение молекул разных сортов, т.е. изменение величин ni, причем таким образом , что возрастание в каком то месте ni для одной из компонент сопровождается одновременным изменением ni для других компонент, так что сумма Ni остается постоянной. Величина определяется M1=-D 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
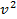 , где р — давление идеального газа, m0 — масса молекулы,
, где р — давление идеального газа, m0 — масса молекулы,  получим основное уравнение МКТ идеального газа в виде:p=2/3 n
получим основное уравнение МКТ идеального газа в виде:p=2/3 n 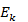 Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О °С принята точка замерзания воды, за 100 °С принята точка кипения воды при нормальном атмосферном давлении).
Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О °С принята точка замерзания воды, за 100 °С принята точка кипения воды при нормальном атмосферном давлении). . Очевидно что сумма всех концентраций равна 1.
. Очевидно что сумма всех концентраций равна 1.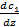 S, где D – коэффициент пропорциональности, наз. коэффициентом диффузии.
S, где D – коэффициент пропорциональности, наз. коэффициентом диффузии.  – градиент абсолютной концентрации в сечении, где мысленно расположили площадку S. Уравнение представляет собой эмпирическое уравнение диффузии. Знак «-» показывает что масса переносится в направлении убывания концентрации данной компоненты
– градиент абсолютной концентрации в сечении, где мысленно расположили площадку S. Уравнение представляет собой эмпирическое уравнение диффузии. Знак «-» показывает что масса переносится в направлении убывания концентрации данной компоненты