
|
|
Химические процессы очистки вод. Удаление из воды соединений Fe и Mn.Хлорирование воды Количество активного хлора, применяемое для хлорирования, зависит от степени загрязнения воды. Для хлорирования прудовой загрязненной воды мы будем применять 15 мг активного хлора из расчета на 1 л воды. 1 мл 1%-ного раствора хлорной извести содержит 2,43 мг активного хлора Х 1%-ного раствора хлорной извести содержит 15 мг активного хлора Х = 15 : 2,43 = 6,17 мл 1%-ного раствора хлорной извести. В 1 л воды наливают 6,17 мл 1%-ного раствора хлорной извести, воду хорошо перемешивают и настаивают в течение 30 минут. Дехлорирование воды Качественное определение в воде остаточного хлора Наличие остаточного хлора определяется по запаху и следующей реакцией: в пробирку наливают 10 мл хлорированной воды, 2-3 капли 5%-ного раствора йодистого калия и столько же крахмала. Голубое окрашивание указывает на наличие остаточного хлора. Определение гипосульфита, необходимого для дехлорирования В колбу наливают 100 мл хлорированной воды, 1 мл 5%-ного раствора йодистого калия, 20 капель раствора крахмала и титруют 0,01 н. раствором гипосульфита до обесцвечивания.
Предположим, что на дехлорирование 100 мл воды ушло 1,3 мл 0,01 н. раствора гипосульфита, тогда на дехлорирование 1 л воды уйдет (1,3 х 1000) : 100 = 13 мл 0,01 н. нормального раствора гипосульфита. Дехлорирование производится сухим веществом гипосульфита. В 1 мл 0,01 н. раствора гипосульфита содержатся 2,48 мг сухого вещества, а в 13 мл 0,1 н. раствора гипосульфита содержатся Х мг сухого вещества. Х = 16 х 2,48 = 32,24 мг сухого вещества. 32,24 мг сухого вещества гипосульфита отвешиваются, высыпаются в воду и перемешиваются до полного растворения. В дехлорированной воде качественно определяется остаточный хлор. Взвешенные вещества — одна из важнейших характеристик состава сточных вод. Этот показатель используется для расчета первичных отстойников и для определения количества образующихся осадков. Концентрация взвешенных веществ в городских сточных водах составляет 100-500 мг/л. С достаточной степенью точности этот показатель может быть определен как разность сухого и плотного остатков. Оседающие вещества — часть взвешенных веществ, которые оседают на дно отстойного цилиндра за 2 ч отстаивания в покое. Длительность отстаивания, равная 2 ч, определена на основании экспериментальных наблюдений, которые показали, что дальнейшее увеличение продолжительности процесса практически не изменяет результата, достигнутого за это время. В городских сточных водах оседающие вещества составляет 65—75% взвешенных веществ по массе. В повседневной контрольной практике для определения оседающих веществ используют цилиндры Лисенко объемом 0,5 или 1 л. Нижняя часть цилиндра представляет собой пробирку с тонкой градуировкой до 0,1 мл. Количество оседающих веществ в городских сточных водах обычно не превышает 6—7 мл/л. После 2 ч отстаивания верхнюю часть отстоявшейся жидкости декантируют, а нижнюю с осевшими веществами переносят в стакан и определяют оседающие вещества по массе, так же как и взвешенные вещества. Таким образом, концентрацию оседающих веществ выражают по объему (мл/л) и по массе (мг/л). Определение оптимальной дозы коагулянта при коагуляции. После взятия пробы сточной воды, необходимо сразу же начать испытания, при той же температуре, которая соответствует промышленным условиям. В пробных испытаниях можно применять концентрированные и разбавленные растворы коагулянта. Рабочий раствор коагулянта готовят, растворяя 1 г. коагулянта (если коагулянт в жидкой форме, то делают перерасчет на 1г. вещества, с учетом плотности) и растворяют в 100 мл. воды, перемешивают мешалкой. Пробная коагуляция должна проходить по всему объему воды, отстаивание должно происходить в спокойном состоянии, необходимо поддерживать постоянную температуру. Таким образом, должны соблюдаться одинаковые условия для всех проб. Для того, чтобы коагуляция проходила по всему объему, необходимо перемешивать раствор мешалкой с интенсивностью 200 обр/мин. в течение 30 сек. и 10 мин. перемешивать с интенсивностью 40 обр/мин. Мешалки после перемешивания вынимают и отстаивают воду 20 – 30 мин. Ни в коем случае сдвигать емкость с пробой, во время отстаивания, нельзя, т.к. это приводит к неправильным показаниям. Разница между температурой начальной с температурой во время опыта не должно быть, поэтому следует проводить такие анализы в неотапливаемых помещениях. В начале опыта вводят большую дозу реагента, от 10 до 50 мг/л., затем при необходимости дозу снижают, до достижения оптимальной дозы (когда остаточного коагулянта на выходе нет). В отфильтрованной воде нужно определить основные характеристики как: цветность, мутность, концентрацию реагента, щелочность. В пробах, где получены хорошие результаты, определяют показатели качества, таких как, окисляемость, рН, содержание катионов и анионов и пр. Пробная коагуляция позволяет определить такие дозы коагулянта, при которых эффективность коагуляции будет выше. Важно знать качество именно отстоявшейся воды. При определении цветности обычным методом возникает некоторая нестыковка: пробу необходимо пропустить через мембранный фильтр для определения оптической плотности. В этом случае результат не будет соответствовать тому, что получен от пробы отстоявшейся воды. Цветность воды при этом будет иметь значение в 2 раза меньше фактического значения. Вследствие данного явления, на многих очистных сооружениях возникает ошибка при определении оптимальных доз реагента (коагулянта) и это касается тех случаев, когда цветность служит показателем очистки сточной воды. В результате многочисленных испытаний было выявлено, что цветность воды, определенная после прохождения через мембранный фильтр, даже если использовать сравнительно малую дозу коагулянта, является удовлетворительной. Хотя, на самом деле, снижение цветности происходит после мембранного фильтрования, а не за счет применения минимальных доз коагулянта. Для того, чтобы этого не происходило, перед определением оптической плотности, не следует пропускать отстоявшуюся воду через мембранный фильтр. На качество воды стандартных критериев на выходе нет: они определяются для каждого очистного сооружения в зависимости от эффективности работы фильтров и отстойников. Ориентировочные дозы, определенные при пробной коагуляции требуют корректировки, так как невозможно рассчитать дозу реагента в лабораторных условиях для реальных промышленных процессов. Нужно подчеркнуть, что очистка воды (коагуляция) протекает эффективно только при определенных дозах реагента. И пока не будет рассчитана эта доза, то и положительного результата не будет видно. Обработка сточной воды малыми дозами коагулянта не улучшает качество воды, а напротив, приводит к повышению мутности. В частности, это касается алюмосодержащих коагулянтов. Химические процессы очистки вод. Удаление из воды соединений Fe и Mn. К химическим методам очистки сточных вод относят нейтрализацию, окисление и восстановление. К окислительным методам относится также электрохимическая обработка. Их применяют для удаления растворимых веществ в замкнутых системах водоснабжения. Химическую очистку проводят иногда как предварительную перед биологической очисткой или после нее как метод доочистки сточных вод. Основными методами химической очистки сточных вод являются нейтрализация и окисление. Нейтрализация сточных вод Сточные воды, содержащие минеральные кислоты или щелочи, перед сбросом их в водоемы или перед использованием в технологических процессах нейтрализуют. Практически нейтральными считаются воды, имеющие pH 6,5...8,5. Нейтрализацию можно проводить различным путем: смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием кислых вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. В процессе нейтрализации могут образовываться осадки. Для нейтрализации кислых вод используют: NaOH, КОН, Na2CO3, NH4OH (аммиачная вода), СаСO3, MgCO3, доломит (CaCO3·MgCO3), цемент. Наиболее доступным реагентом является гидроксид кальция (известковое молоко) с содержанием 5...10% активной извести Са(ОН)2. Иногда для нейтрализации применяют отходы производства, например шлаки металлургических производств. Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. Окислительный метод очистки применяют для обезвреживания производственных сточных вод, содержащих токсичные примеси (цианиды, комплексные цианиды меди и цинка) или соединения, которые нецелесообразно извлекать из сточных вод, а также очищать другими методами (сероводород, сульфиды). Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др. В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды.
Процессы обеззараживания. 1. Хлорирование
Биологические методы очистки применяют с использованием специальных штаммов, рас микроорганизмов, строго специфично способны поглощать определенные вещества - неорганические, например тяжелые металлы, органические - нефтепродукты Пр роцес ведут в присутствии воздуха - аэробные микроорганизмы, или без воздуха - анаэробы в специальных устройствах - аэротенках, биотенках, на специальных территориях - полях фильтрационныеї. Для биологической очистки стоков существуют специально созданные пруды и поля фильтрации, где под воздействием все тех же микроорганизмов и протекает процесс очищения. Но минусом таких сооружений является сезонный принцип работы, опасность попадания загрязнений в грунтовые воды и, конечно же, необходимость в больших земельных площадях. Следовательно существует много современных методов, устройств, способных очищать сточные воды Использование определенного из них зависит от состава загрязнений в воде, дальнейшего ее использования и выделенных веществ Вода, как и нефть, уголь, природный газ дорожает, поэтому очищенную воду надо снова направлять в технологические процессы, создавая замкнутые технологические циклли. Процесс самоочищения водоемов. Защита металлических конструкций и трубопроводов от коррозии.
Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению:
Гидроксид железа Fe(OH)3 и является тем, что называют ржавчиной.В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Типы коррозии Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
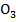 – сильнейший окислитель. Он значительно улучшает органолептические свойства, губительно действует на вирусы, бактерии.
– сильнейший окислитель. Он значительно улучшает органолептические свойства, губительно действует на вирусы, бактерии.

