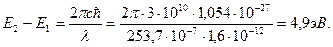|
|
Постулаты Бора. Опыты Франка и Герца12 Планетарная модель атома. Модель атома Томсона. Опыты Резерфорда по рассеянию альфа-частиц. Ядерная модель атома Для объяснения характера спектра, испускаемого изолированным атомом, следовало предположить, что электрон в излучающем атоме совершает гармонические колебания пол действием квазиупругой силы, пропорциональной смещению электрона от положения равновесия. В 1903 году Томсон предложил модель атома, согласно которой атом представляет собой заполненную положительным электричеством сферу, внутри которой находится электрон. Суммарный положительный заряд сферы равен заряду электрона е. Напряженность поля внутри равномерно заряженной сферы Согласно модели Резерфорда любой атом состоит из положительно заряженного ядра и окружающей его электронной оболочки. Размеры ядра менее 10-12 см, размеры же самого атома, определяемые электронной оболочкой, порядка 10-8 см, т. е. в десятки тысяч раз больше размеров ядра. При этом практически вся масса атома сосредоточена в ядре. Если все это так, то атом должен быть в высокой степени прозрачным для пронизывающих его частиц. Экспериментальное доказательство изложенной модели атома было дано Резерфордом (1911) с помощью рассеяния α- частиц (ядер атомов Не) тонкой металлической фольгой.
Исходя из предположений, что взаимодействие указанных α-частиц с ядром является кулоновским, а заряд и масса ядра локализованы в очень малой области атома, Резерфорд разработал количественную теорию рассеяния α-частиц и вывел формулу для распределения рассеянных α-частиц в зависимости от угла отклонения θ. В своих рассуждениях Резерфорд принимал во внимание рассеяние α-частиц только на ядрах, поскольку заметного отклонения α-частиц электронами не может быть из-за того, что масса электронов на четыре порядка меньше массы α-частиц. Когда α-частица пролетает вблизи ядра, ее траектория представляет собой гиперболу, причем угол отклонения α-частицы — угол θ — равен углу между асимптотами гиперболы (рис.1). Для угла θ было получено выражение
где q и q0 — заряды налетающей частицы и ядра, b — прицелъный параметр, т. е. расстояние от ядра до первоначального направления движения налетающей частицы, когда она находится вдали от ядра (см. рис. 4.1), Из формулы (4.1) видно, что чем меньше прицельный параметр b, тем больше угол отклонения θ. Непосредственная проверка формулы (4.1) экспериментально невозможна, поскольку мы не можем измерить прицельный параметр b налетающей частицы. Однако, следуя Резерфорду, мы можем положить формулу (4.1) в основу для следующих расчетов. Рассмотрим тонкий слой рассеивающего вещества, настолько тонкий (фольга), чтобы каждая налетающая частица пучка претерпевала лишь однократное отклонение. Для отклонения в интервале углов (θ, θ+dθ) прицельный параметр должен быть заключен в интервале (b, ,b+db). При этом значения dθ и db будут связаны определенным соотношением. Чтобы найти его, перепишем сначала (4.1) в виде
а затем возьмем дифференциал от этого выражения
Пусть площадь поперечного сечения узкого пучка налетающих частиц равна S. Тогда число ядер рассеивающего тонкого слоя будет равно nS, где n — число ядер (атомов) в расчете на единицу поверхности. При этом относительное число частиц, имеющих прицельный параметр b в интервале (b,b+db)и, значит, рассеянных в интервале углов (θ,θ+dθ), будет равно (рис.4. 2)
где dS — суммарная площадь колец в сечении S пучка, dN — поток частиц,рассеянных в интервале углов(θ,θ+dθ), и N — поток падающих частиц в пучке. Подставив в (4.4) выражения для b и db из(4.2) и (4.3), получим:
Умножим числитель и знаменатель правой части этого равенства на sin(θ/2). Тогда
где выражение 2π sinθ dθ — это телесный угол dΩ, в пределах которого заключены углы рассеяния (θ,θ+dθ). Поэтому (4.6) можно переписать так:
Это и есть формула Резерфорда. Она определяет относительное число частиц, рассеянных в телесном угле dΩ под углом θ к первоначальному направлению их движения. Напомним, что в этой формуле п— число ядер на единицу поверхности рассеивающего слоя (фольги). Если нас интересует относительное число ∆N/N частиц в конечном интервале углов от θ1 до θ2, то выражение (4.7) надо проинтегрировать, учитывая, что dΩ=2π sinθ dθ. При этом следует иметь в виду, что для малых углов рассеяния (приблизительно меньших 3°) формула Резерфорда не применима. Это связано с тем, что очень малым углам соответствуют большие значения прицельного параметра, выходящие за пределы атома, где сила уже не имеет кулоновского характера. Эффективное сечение. Формулу Резерфорда (4.7) можно представить в несколько ином виде, если ввести понятие дифференциального сечения dσ, равного площади кольца радиусом b и шириной db (см. рис.4. 2). Имея прицельные параметры в интервале (b,b+db), налетающие частицы отклоняются ядрами согласно (4.1) на углы в интервале (θ,θ+dθ). Поскольку
формулу (4.7) можно представить так:
где дифференциальное эффективное сечение
Таким образом, формула (4.9) означает, что относительное число частиц, рассеянных в интервале углов (θ,θ+dθ), равно произведению количества ядер на единицу поверхности фольги (n) на соответствующее дифференциальное сечение (4.10).
Постулаты Бора. Опыты Франка и Герца Постулаты Бора. Абсолютная неустойчивость планетарной модели Резерфорда и вместе с тем удивительная закономерность атомных спектров, и в частности их дискретность, привели Н. Бора к необходимости сформулировать (1913) два важнейших постулата квантовой физики: Атом может длительное время находиться только в определенных, так называемых стационарных состояниях, которые характеризуются дискретными значениями энергии E1, E2, Е3, ... В этих состояниях, вопреки классической электродинамике, атом не излучает. При переходе атома из стационарного состояния с большей энергией E2 в стационарное состояние с меньшей энергией E1 происходит излучение кванта света (фотона) с энергией ħω: ħω =E2-E1. (4.11) Такое же соотношение выполняется и в случае поглощения, когда падающий фотон переводит атом с низшего энергетического уровня E1на более высокий E2, а сам исчезает. Соотношение (4.11) называют правилом частот Бора. Заметим, что переходы атома на более высокие энергетические уровни могут быть обусловлены и столкновением с другими атомами. Таким образом, атом переходит из одного стационарного состояния в другое скачками (их называют квантовыми). Что происходит с атомом в процессе перехода — этот вопрос в теории Бора остается открытым. Опыты Франка и Герца (1913). Эти опыты дали прямое доказательство дискретности атомных состояний. Идея опытов заключается в следующем. При неупругих столкновениях электрона с атомом происходит передача энергии от электрона атому. Если внутренняя энергия атома изменяется непрерывно, то атому может быть передана любая порция энергии. Если же состояния атома дискретны, то его внутренняя энергия при столкновении с электроном должна изменяться также дискретно — на значения, равные разности внутренней энергии атома в стационарных состояниях. Следовательно, при неупругом столкновении электрон может передать атому лишь определенные порции энергии. Измеряя их, можно определить значения внутренних энергий стационарных состояний атома. Это и предстояло проверить экспериментально с помощью установки, схема которой показана на рис.4. 4. В баллоне с парами ртути под давлением порядка 1 мм.рт.ст. (~ 130 Па) имелись три электрода: К — катод, С — сетка и А — анод. Электроны, испускаемые горячим катодом вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов U между катодом и сеткой. Величину U можно было плавно менять. Между сеткой и анодом создавалось слабое тормозящее поле с разностью потенциалов около 0,5В. Таким образом, если какой-то электрон проходит сквозь сетку с энергией, меньшей 0,5 эВ, то он не долетит до анода. Только те электроны, энергия которых при прохождении сетки больше 0,5 эВ, попадут на анод, образуя анодный ток I, доступный измерению. В опытах (см. рис. 4.4) исследовалась зависимость анодного тока I (гальванометром G) от ускоряющего напряжения U (вольтметром V). Полученные результаты представлены на рис.4. 5. Максимумы соответствуют значениям энергии Е1 = 4,9 эВ, Е2 = 2Е1, Е3 = ЗЕ1 и т. д. Такой вид кривой объясняется тем, что атомы действительно могут поглощать лишь дискретные порции энергии, равные 4,9 эВ. При энергии электронов, меньшей 4,9 эВ, их столкновения с атомами ртути могут быть только упругими (без изменения внутренней энергии атомов), и электроны достигают сетки с энергией, достаточной для преодоления тормозящей разности потенциалов между сеткой и анодом. Когда же ускоряющее напряжение U становится равным 4,9 В, электроны начинают испытывать вблизи сетки неупругие столкновения, отдавая атомам ртути всю энергию, и уже не смогут преодолеть тормозящую разность потенциалов в пространстве за сеткой. Значит, на анод А могут попасть только те электроны, которые не испытали неупругого столкновения. Поэтому, начиная с ускоряющего напряжения 4,9 В, анодный ток I будет уменьшаться. При дальнейшем росте ускоряющего напряжения достаточное число электронов после неупругого столкновения успевает приобрести энергию, необходимую для преодоления тормозящего поля за сеткой. Начинается новое возрастание силы тока I. Когда ускоряющее напряжение увеличится до 9,8 В, электроны после одного неупругого столкновения достигают сетки с энергией 4,9 эВ, достаточной для второго неупругого столкновения. При втором неупругом столкновении электроны теряют всю свою энергию и не достигают анода. Поэтому анодный ток I начинает опять уменьшаться (второй максимум на рис. 4.5). Аналогично объясняются и последующие максимумы. Из результатов опытов следует, что разница внутренних энергий основного состояния атома ртути и ближайшего возбужденного состояния равна 4,9 эВ, что и доказывает дискретность внутренней энергии атома. Аналогичные опыты были проведены в дальнейшем с атомами других газов. И для них были получены характерные разности потенциалов, их называют резонансными потенциалами или первыми потенциалами возбуждения. Резонансный потенциал соответствует переходу атома с основного состояния в ближайшее возбужденное. Для обнаружения более высоких возбужденных состояний была использована более совершенная методика, однако принцип исследования оставался тем же. Итак, все опыты такого рода приводят к заключению, что состояния атомов изменяются лишь дискретно. Опыты Франка и Герца подтверждают также и второй постулат Бора — правило частот. Оказывается, что при достижении ускоряющего напряжения 4,9 В пары ртути начинают испускать ультрафиолетовое излучение с длиной волны 253,7 нм. Это излучение связано с переходом атомов ртути из первого возбужденного состояния в основное. Действительно, из условия (4.11) следует, что
Этот результат хорошо согласуется с предыдущими измерениями.
4.3. Эмпирические закономерности в атомных спектрах. Формула Бальмера.Линейчатые спектры атомов. Комбинационный принцип Ритца Чтобы получить согласие с результатами наблюдений, Бор предположил, что электрон в атоме водорода движется только по тем круговым орбитам, для которых его момент импульса M=nħ, n=1,2,3,…, (4.12) где n — квантовое число. С помощью этого правила квантования можно найти радиусы круговых стационарных орбит водородоподобных систем (Н, Не+, Li++...) и соответствующие им энергии. Пусть заряд ядра водородоподобной системы равен Ze. Масса ядра значительно больше массы электрона, поэтому ядро при движении электрона можно считать неподвижным. Следуя Бору, будем предполагать, что электрон движется вокруг ядра по окружности радиуса r. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
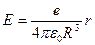 , где
, где 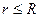 , R – радиус сферы. Сила, действующая на электрон, находящийся внутри сфера на расстоянии r от ее центра равна
, R – радиус сферы. Сила, действующая на электрон, находящийся внутри сфера на расстоянии r от ее центра равна 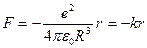 . В этих условиях электрон, выведенный каким-либо образом из положения равновесия, будет совершать гармонические колебания с частотой
. В этих условиях электрон, выведенный каким-либо образом из положения равновесия, будет совершать гармонические колебания с частотой 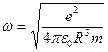 , где т- масса электрона. Размеры атома, вычисленные по этой модели, совпадают по порядку величины с газокинетическими размерами атома. Однако модель оказалась несостоятельной.
, где т- масса электрона. Размеры атома, вычисленные по этой модели, совпадают по порядку величины с газокинетическими размерами атома. Однако модель оказалась несостоятельной.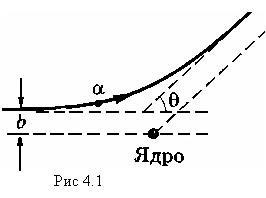 Было обнаружено, что подавляющее число α- частиц рассеивалось на небольшие углы (не больше ~ 3°). Вместе с тем наблюдались также отдельные α- частицы, рассеянные на большие утлы. Относительно последних Резерфорд сделал вывод, что такие частицы появляются в результате единичного акта их взаимодействия с ядром атома.
Было обнаружено, что подавляющее число α- частиц рассеивалось на небольшие углы (не больше ~ 3°). Вместе с тем наблюдались также отдельные α- частицы, рассеянные на большие утлы. Относительно последних Резерфорд сделал вывод, что такие частицы появляются в результате единичного акта их взаимодействия с ядром атома.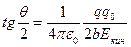 , (4.1)
, (4.1)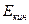 — кинетическая энергия частицы вдали от ядра.
— кинетическая энергия частицы вдали от ядра.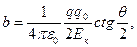 (4.2)
(4.2)
 (4.3)
(4.3) Знак минус в этом выражении обусловлен тем, что знаки db и dθ взаимно противоположны. В дальнейшем существенным будет лишь модуль величин db и dθ, поэтому знак минус в (4.3) мы не будем учитывать.
Знак минус в этом выражении обусловлен тем, что знаки db и dθ взаимно противоположны. В дальнейшем существенным будет лишь модуль величин db и dθ, поэтому знак минус в (4.3) мы не будем учитывать.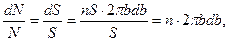 (4.4)
(4.4)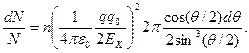 (4.5)
(4.5)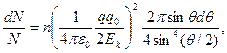 (4.6)
(4.6)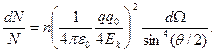 (4.7)
(4.7) (4.8)
(4.8)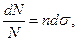 (4.9)
(4.9)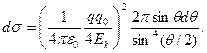 (4.10)
(4.10)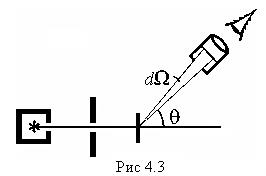 Проверка формулы Резерфорда. Формула (4.7) была подтверждена экспериментально. В качестве налетающих частиц использовали α-частицы (их заряд q = 2e) от радиоактивного источника. Кинетическая энергия α-частиц была порядка нескольких МэВ. Если зафиксировать телесный угол dΩ, в котором подсчитывают рассеянные α-частицы, и менять при этом угол θ (рис.4.3), то из формулы (4.7) следует, что dN • sin4(θ/2) = const. На опыте прежде всего было проверено соблюдение именно этого условия. , и было доказано, что формула (4.7) правильно описывает процесс рассеяния α-частиц.
Проверка формулы Резерфорда. Формула (4.7) была подтверждена экспериментально. В качестве налетающих частиц использовали α-частицы (их заряд q = 2e) от радиоактивного источника. Кинетическая энергия α-частиц была порядка нескольких МэВ. Если зафиксировать телесный угол dΩ, в котором подсчитывают рассеянные α-частицы, и менять при этом угол θ (рис.4.3), то из формулы (4.7) следует, что dN • sin4(θ/2) = const. На опыте прежде всего было проверено соблюдение именно этого условия. , и было доказано, что формула (4.7) правильно описывает процесс рассеяния α-частиц.