|
|
СПИСОК ИСПОЛЬЗОВАННЫХ БИБЛИОГРАФИЧЕСКИХ ИСТОЧНИКОВКАРИМОВА ГЕЛЮСЯ РАВКАТЬЕВНА
НАЗВАНИЕ
Студент __ курса Группа ____ _________________ (Каримова Г.Р)
Казань–2016
СОДЕРЖАНИЕ ВВЕДЕНИЕ............................................................................................................... (Литературный обзор).............................................................................................. 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ................................................................ 2.1 Постановка задачи.............................................................................................. 2.2 Материалы и реагенты....................................................................................... 2.3 Приборы и методы эксперимента.................................................................... 3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.................................................................. ВЫВОДЫ................................................................................................................... 31 СПИСОК ИСПОЛЬЗОВАННЫХ БИБЛИОГРАФИЧЕСКИХ ИСТОЧНИКОВ........................................................................................................ 32 В В Е Д Е Н И Е Методы потенциометрического анализа являются одними из старейших в электроаналитической химии. Благодаря бестоковому режиму потенциометрические измерения не приводят к изменениям состава анализируемого образца, а простота конструкции ионселективных электродов (ИСЭ) позволяет использовать их в полевых условиях и интегрировать в автоматические системы контроля. В традиционных ИСЭ измерение концентрации потенциалопределяющего иона производится относительно внутреннего стандартного раствора, отделённого от анализируемого раствора мембраной, обеспечивающей селективный транспорт иона. Такая конструкция имеет ряд ограничений, из которых наиболее важными являются обменные процессы «перетока» ионов под действием пассивного транспорта, контролируемого диффузией и отчасти миграцией. Это приводит к завышению предела обнаружения потенциалопределяющего иона. Также вероятны нарушение герметичности крепления мембраны и изменение параметров ее проницаемости и омического сопротивления в процессе хранения ИСЭ и его эксплуатации. Наличие жидкостного контакта ограничивает возможности миниатюризации, хотя в биолого-медицинских исследованиях используют микроэлектроды с жидкостной мембраной, удерживаемой капиллярными силами в тонкой стеклянной трубке. Альтернативой ИСЭ с жидкостным контактом являются электроды с твердым внутренним контактом, известные более 30 лет. В простейшем случае для изготовления такого электрода используют стандартный корпус ИСЭ, но токосъемник приклеивают непосредственно к внутренней стороне мембраны. Вариантом является наложение мембраны на поверхность планарного токосъемника, в свою очередь, закрепленного на непроводящем субстрате. Однако первые эксперименты в области твердоконтактных ИСЭ показали неустойчивость потенциала, его значительный дрейф при эксплуатации и резкое снижение параметров селективности и чувствительности по сравнению с традиционными ИСЭ с жидкостным внутренним контактом. Многие из указанных недостатков связаны с возникновением так называемого запорного потенциала на границе сред с различным характером проводимости – ионным для анализируемого раствора и электронным для металлического токосъемника, а также более выраженное влияиние на потенциал такого электрода растворенного кислорода. Одним из способов решения указанных проблем является модификация электрода веществами, способными к ионному обмену с раствором и одновременно обладающими электрохимической активностью. Первоначально с этой целью использовались оксиды переходных металлов, однако в настоящее время основное внимание уделяется ИСЭ на основе электрополимеризованных материалов
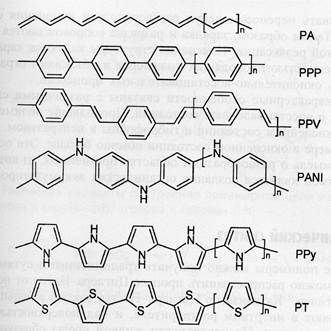
(Литературный обзор) Электрополимеризованные материалы образуются на поверхности электрода в химической реакции, инициируемой анодным окислением мономера. Обычно реакция начинается с образования катион-радикала при высоких анодных потенциалах. Пленка полимера меняет характеристики поверхности, что выражается в закономерном снижении тока по мере накопления целевого продукта. Условия полмеризации весьма сильно влияют на характеристики покрытия, в том числе, их электрохимическую ионообменную активность. В настоящее время выделяют три группы продуктов электрополимеризации: - соединения, обладающие электропроводностью и электрохимической ктивностью благодаря наличию в молекулах конъюгированных двойных связей и редокс-центров. В составе электрохимических сенсоров этой группы применяют в основном произодный полианилина, полипирррола, и политиофена (рис.1), в том числе допированные электрохимически активными низкомолекулянизкомолекулярными соединениями;
Рисунок 1. Некоторые типичные проводящие полимеры. PA – транс-полиацетилен, PPP- поли(n-фенилен), PPV – поли(n-фениленвинилен), PANI – полианилин, PPy – полипиррол, PT - политиофен -соединения, обладающие электрохимической активностью, но проявляющие электропроводность в узком интервале потенциалов, соответствующих обратному переносу электрона. К числу таких соединений относят, например, полимерные формы фенотиазиновых и феноксазинговых красителей
Статья poten7 Авторы под руководством М.Х. Порнаджи-Азар изучили реакцию между тетрабутиламмония периодатом и фенотиазином в присутствии сильных кислот в хлороформе. В качестве электрода брали платиновую или платиновый диск. Определяли средства на основе фенотиазинов по 2м методам: 1 Путем растворения лекарственных препаратов в хлороформе. 2 Титрованием стандартным раствором и другим титрантом. В результате получили (табл и графики) Статья El-polymer 165 Авторы во главе с Делиа Глигори изучили реакцию фотокаталитического окисления никотинамидодениндинуклеотида новым полимерным фенотиазином. В качестве электрода использовали графитовые электроды. Проводили электрохимические измерения при pH=7.0 , kobs, [NADH]=0 = 3.9*103 M-1 S-1 . В результате получаем (табл. и гр.) Статья cnt6 Авторы во главе с Назан С. Лоренц рассмотрели химическую адсорбцию фенотиазиновых красителей на углеродных нанотрубках.
ЭКСПЕРИМЕНТАЛЬАЯ ЧАСТЬ Постановка задачи В рамках выполнения практической работы нами были поставлены следующие задачи: Материалы и реагенты В работе использовали азотную кислоту (ООО НПО «ТатХимПродукт», г. Казань), универсальный буфер, NaOH(конц.), желтую и красную кровяные соли, в качестве ионофора был использован полифенилтиазин (ПФТА), синтезированные и предоставленные для исследования В.В. Горбачуком (кафедра органической химии Химического института им. А.М.Бутлерова КФУ) Структурные формулы полифенилтиазинов, использованных в качестве модификаторов электродов, представлены на рисунке .
Рисунок 20. Структурные формулы
Приборы и методы В качестве рабочих использовали планарные электроды, электродом сравнения – хлоридсеребряный электрод. Измерения проводили в двухэлектродной ячейке. Контроль величины pH и потенциометрические измерения проводили с помощью pH-метра-иономера "Эксперт – 001" (электрод ЭВЛ-1М3.1) производства НПП "Эконикс-Эксперт", г.Москва. Дозирование реагентов при приготовлении растворов и проведении измерений производили с помощью микродозаторов «Ленпипет», Unipipette 2010 и Vari (“Plastomed”, Польша). Перемешивание раствора в ячейке осуществляли с помощью магнитной мешалки. Статистическую обработку результатов проводили с помощью пакета прикладных программ Microcal Origin 8.1. Методика измерений Для измерения сигнала полученный потенциометрический сенсор и электрод сравнения погружали в ячейку с универсальным буфером и при непрерывном перемешивании измеряли потенциал электрода.
Приготовление растворов Потенциометрические измерения проводили в универсальном буфере. Буферные растворы готовилииз точных навесок компонентов в дистиллированной воде с последующей корректировкой рН с помощью концентрированного раствора NaOH. Приготовление буферных растворовпроизводили из точных навесок указанных компонентов в дистиллированной воде с последующей корректировкой рН. Приготовление рабочих растворов.Для приготовлениярастворакрасной кровяной соли (K3[Fe(CN)6]) взвесили 0,329 г сухого K3[Fe(CN)6] и растворили его в 10 мл дистиллированной воды для получения 0,1 М раствора. Для приготовления 0,1 М раствора желтой кровяной солиK4[Fe(CN)6] взвешиваем 0,422 г сухого K4[Fe(CN)6] и растворяем его в 10 мл дистиллированной воды. Для получения 0,5 М раствора желтой кровяной соливзвешиваем 2,11 г сухого K4[Fe(CN)6] и растворяем его в 10 мл дистиллированной воды. Для получения 0,01 М раствора желтой кровяной солиK4[Fe(CN)6] берем 10 мкл 0,1 М раствора желтой кровяной соли и добавляем 910 мкл дистиллированной воды.
Модификация электродов На электрод наносился раствор рецептора (2мкл) и высушивался под тягой несколько минут. В качестве рецептора брали полифенилтиазин. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ПФТА1
ПФТА 2
ПФТА 1
ПО СКОРОСТИ РАЗВЕРТКИ ПОТЕНЦИАЛА
ПФТА 2
ПО СКОРОСТИ РАЗВЕРТКИ ПОТЕНЦИАЛА
ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННЫХ БИБЛИОГРАФИЧЕСКИХ ИСТОЧНИКОВ

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|