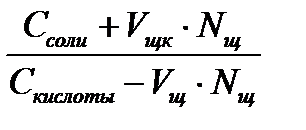|
|
Буферные системы организма.12 Саратовский государственный университет (ГОУ ВПО Саратовский ГМУ Росздрава)
О.П. Семёнова, Р.Т. Куцемако, П.В. Решетов БУФЕРНЫЕ РАСТВОРЫ КИСЛОТНО – ОСНОВНОЕ РАВНОВЕСИЕ. Методическая разработка к лабораторно – практическому занятию (для студентов лечебного и педиатрического факультетов)
Саратов
Федеральное агентство по здравоохранению и социальному развитию
Государственное образовательное учреждение высшего профессионального образования
Саратовский государственный университет (ГОУ ВПО Саратовский ГМУ Росздрава) О.П. Семёнова, Р.Т. Куцемако, П.В. Решетов БУФЕРНЫЕ РАСТВОРЫ. КИСЛОТНО – ОСНОВНОЕ РАВНОВЕСИЕ. Методическая разработка к лабораторно – практическому занятию (для студентов лечебного и педиатрического факультетов) Саратов
УДК 546 /07/541.6 Методическая разработка является руководством к выполнению практической работы по теме: «Буферные растворы. Кислотно – основное равновесие». Она составлена для студентов по специальностям: Лечебное дело и Педиатрия в соответствии с «Программой для студентов факультетов по специальности: Лечебное дело и Педиатрия медицинских вузов». В методической разработке вопросы теории и практики соединены в единую форму занятий. Выполнение опытов построено как самостоятельное научное исследование. Последовательность расположения заданий служит установлению логической связи между основными понятиями и раскрытию обобщающих закономерностей. Авторы-составители:О.П. Семёнова, кандидат медицинских наук, ассистент кафедры общей и биоорганической химии СГМУ Р.Т. Куцемако, кандидат биологических наук, доцент кафедры общей и биоорганической химии СГМУ, П.В. Решетов, доктор химических наук, профессор, зав. кафедрой общей, биоорганической химии СГМУ, Под общей редакцией профессора Решетова П.В. Рецензенты:доктор химических наук, профессор Федотова О.В.
Рекомендовано к изданию ЦМКС СГМУ
© Куцемако Р.Т. Семёнова О.П. Решетов П.В.
© Саратовский медицинский университет, 2011 г.
Буферные растворы Цель занятия: Сформировать у студентов системные знания о буферных растворах, их свойствах, механизме действия, их взаимосвязи и роли в поддержании кислотно – основного гомеостаза организма, наиболее важных показателях кислотно – основного гомеостаза, механизмах его поддержания. Научить студентов прогнозировать влияние различных факторов на величину рН и буферной ёмкости буферных систем и биологических жидкостей и механизмы действия буферных растворов в зависимости от их типа, количественно рассчитывать величину рН буферных растворов и буферной ёмкости. Обоснование темы. Для живых организмов характерно поддержание кислотно-основного гомеостаза на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии протолитов. В процессе метаболизма в организме постоянно происходит синтез, распад и взаимодействие огромного количества химических соединений. Все эти процессы осуществляются при помощи ферментов, активность которых связана с определённым значением рН. Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме как в условиях физиологии, так и патологии. Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР.
Контрольные вопросы к теме: 1. Какие растворы называются буферными растворами ? 2. Классификация буферных растворов. 3. Механизм буферного действия. 4. Уравнение Гендерсона – Гассельбаха для определения рН и рОН протолитических буферных растворов. 5. Факторы, влияющие на рН и рОН буферных растворов. 6. Буферная ёмкость. 7. Зона буферного действия. 8. Количественное определение буферной ёмкости. 9. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая и протеиновая. 10. Взаимодействие буферных систем в организме. 11. Кислотно-основное равновесие. 12. Основные показатели КОР 13. Возможные причины и типы нарушений КОР организма 14. Применение реакции нейтрализации в фармакотерапии для коррекции КОР: лекарственные средства с кислотными и основными свойствами. Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию. Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы. Различают в основном протолитические буферные растворы двух типов: · Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного кислота основания СН3СООNa → Na+ + CH3COO-
· Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток Основание сопряженной NH4Cl → Cl- + NH4+ кислоты
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха: рН = рК + ℓg где рК = -ℓg КД. С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде. 1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН. CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным. При добавлении кислоты к буферу рН определяется по формуле: рН = рК + ℓg
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾: CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В.Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным. При добавлении щелочи рН определяется по формуле: рН = рК + ℓg 3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными. Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Значения рН различных биологических жидкостей и тканей организма.
Для количественной характеристики буфера вводится понятие буферной ёмкости. Буферная ёмкость Это способность буферной системы противодействовать изменению рН среды. Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия. Она равна рН = рК ± 1 Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу. В = В – буферная ёмкость, nЭ – количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи) рНК – конечное значение рН (после добавления кислоты или щелочи) ΔрН – изменение рН. На практике буферная ёмкость рассчитывается по формуле: В = V – объём кислоты или щелочи, N – эквивалентная концентрация кислоты или щелочи, Vбуф.- объём буферного раствора, Δ рН – изменение рН. О противодействии изменению рН крови свидетельствуют следующие данные. Чтобы сдвинуть рН крови на единицу в щелочную область, нужно прибавить в кровь в 70 раз больше количества NaOH, чем в такой же объём чистой воды. Для изменения рН на единицу в кислую область, следует в кровь добавить в 320 раз больше количества соляной кислоты, чем к такому же объёму чистой воды. Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице. Буферная ёмкость артериальной крови 25,3 ммоль/л, венозной – 24,3 ммоль/л, слюна обладает буферной ёмкостью и определяется бикарбонатной, фосфатной и белковой системами. Буферная ёмкость слюны изменяется под влиянием ряда факторов: углеводистая диета снижает буферную ёмкость слюны, высокобелковая диета – повышает её. Поражаемость зубов кариесом меньше у лиц с высокой буферной ёмкостью. В организме человека действуют белковый, гемоглобиновый, фосфатный и бикарбонатный буферы. Буферные системы организма. Бикарбонатный буфер. Он составляет 53 % буферной ёмкости и представлен: Н2СО3 NaHCO3 Соотношение 1 : 20 Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Механизм действия. 1. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2 2.При увеличении щелочности крови концентрация НСО3- увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О. Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным.
Гемоглобиновый буфер Составляет 35 % буферной ёмкости. Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами: HHb ↔ H+ + Hb- HHbO2 ↔ H+ HbO2- Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается. Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СО3 ↔ КНСО3 + ННb. Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот. Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена. В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2. В лёгких: ННb + O2 ↔ HHbO2; HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑ В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3- Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер.
Фосфатный буфер Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-. Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4 : 1 . Следовательно, эта система имеет буферную ёмкость по кислоте больше, чем по основанию. Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2- : Н + + НРО4 2- ↔ Н2РО4 1- Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи. При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 1-: ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается. Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез, в моче. Белковый буфер Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием. Pt – COOH - белок-кислота Pt – COONa – белок-соль 1. При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + Pt-COONa ↔ Pt-COOH + NaCl. По закону разбавления В.Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется. 2. При увеличении щелочных продуктов они взаимодействуют с Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется. Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Рассмотрим взаимодействие буферных систем в организме по стадиям: 1. В процессе газообмена в легких кислород поступает в эритроциты, где протекает реакция: ННb + O2 ↔ HHbO2 ↔ Н+ + HbO2- 2. По мере перемещения крови в периферические отделы кровеносной системы происходит отдача кислорода ионизированной формой HbO2- HbO2-↔ Нb- + О2 Кровь при этом из артериальной становится венозной. Отдаваемый в тканях кислород расходуется на окисление различных субстратов, в результате чего образуется СО2, большая часть которого поступает в эритроциты. 3. В эритроцитах в присутствии карбоангидразы со значительной скоростью протекает следующая реакция: СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3- 4. Образующийся избыток протонов связывается с гемоглобинат-ионами: Н+ + Нb- → HHb Связывание протонов смещает равновесие реакции стадии (3) вправо, вследствие чего концентрация гидрокарбонат ионов возрастает и они диффундируют через мембрану в плазму. В результате встречной диффузии ионов, отличающихся кислотно-основными свойствами (хлорид-ион протолитически неактивен; гидрокарбонат ион в условиях организма является основанием), возникает гидрокарбонатно-хлоридный сдвиг. Этим объясняется более кислая реакция среды в эритроцитах (рН = 7,25) по сравнению с плазмой (рН = 7,4). 5. Поступающие в плазму гидрокарбонат-ионы нейтрализуют накапливающийся там избыток протонов, возникающий в результате метаболических процессов: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2 6. Образовавшийся СО2 взаимодействует с компонентами белковой буферной системы: СО2 + Рt-NH2 ↔ Pt-NHCOOH ↔ H+ + Pt-NHCOO- 7. Избыток протонов нейтрализуется фосфатным буфером: Н+ + НРО4- ↔ Н2РО4- 8. После того как кровь вновь попадает в легкие, в ней увеличивается концентрация оксигемоглобина (стадия 1), который реагирует с гидрокарбонат-ионами, не диффундировавшими в плазму: НСО3- + ННbО2 ↔ НbО2- + СО2 + Н2О Образующийся СО2 выводится через легкие. В результате уменьшения концентрации НСО3- ионов в этой части кровеносного русла наблюдаются их диффузия в эритроциты и диффузия хлорид-ионов в обратном направлении. 9. В почках также накапливается избыток протонов в результате реакции: СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-, который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер): H+ + NH3 ↔ NH4+ Таким образом, гемоглобиновая система участвует в двух процессах: · Связывание протонов, накапливающихся в результате метаболических процессов; · Протонирование гидрокарбонат-ионов с последующим выделением СО2 Гемоглобиновую буферную систему можно рассматривать как одно из важнейших звеньев в транспорте СО2 из тканей в легкие. Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 , pOH = pK + ℓg
, pOH = pK + ℓg  ,
,