
|
|
Состав и теплота сгорания горючих веществМинистерство образования и науки РФ Северный (Арктический) федеральный университет Имени М.В. Ломоносова ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методические указания к выполнению Расчётно-графической работы
Архангельск 2013 УДК 536.7 ББК К 26
Рецензенты: В.К. Любов, д-р техн. наук, проф., зав. каф. ПТЭ Е.Г. Царев, канд. техн. наук, проф., зав. каф. БТПиП
Карпов С.В. К 26Теория горения и взрыва: Методические указания к выполнению расчетно – графической работы. –Архангельск: изд. САФУ, 2013. - 30 с. ISBN Методические указания предназначены для студентов II курса института комплексной безопасности (ИКБ), обучающихся по направлению подготовки 280700.62 «Техносферная безопасность» (бакалавр), профилям «Защита в чрезвычайных ситуациях», «Пожарная безопасность», «Промышленная безопасность» дневной формы обучения при изучении курса «Теория горения и взрыва». Могут быть полезны студентам технических специальностей при изучении курса «Теплотехника». Табл.13. Ил. 1. Библиогр. 12 назв. УДК 536.7 ББК
Рекомендовано к изданию методической комиссией Института энергетики и транспорта ISBNÓ Северный (Арктический) федеральный университет имени М.В. Ломоносова, 2013
Ó Карпов С.В., 2013 Введение Теория горения и взрыва (ТГВ) – комплексная общепрофессиональная дисциплина, изучающая физико-химические, гидрогазодинамические и тепломассообменные основы процессов горения и взрыва. Горение – сложный быстропротекающий самоускоряющийся процесс физико-химических и структурных превращений горючих веществ в среде окислителя, сопровождающийся выделением значительного количества тепловой энергии, образованием продуктов сгорания и световым излучением. Взрыв – частный случай процесса горения, отличающийся высокой скоростью распространения пламени (до значений порядка 1000 м/с), резким повышением давления (до 10…20 МПа и более), температуры (до 2000…3500°С) и свечением. В настоящее время горение и взрыв рассматриваются как важная интенсивно развивающаяся область научно-технического прогресса [1], имеющая прочные научные основы и многочисленные практически важные приложения. Так процессы горения играют исключительно важную роль в энергетике, технике, различных теплотехнологиях и реализуются в топочных и печных устройствах, камерах сгорания газотурбинных, реактивных и ракетных двигателей, генераторах сушильных газов, энерготехнологических химических реакторах и других устройствах. Горючими веществами являются твердые, жидкие и газообразные виды ископаемого топлива, древесина, пластмасса, синтетические виды моторного топлива, пожаровзрывоопасные материалы. Процессы взрыва широко используются в военном деле для поражения военной техники, инженерных фортификационных сооружений и живой силы противника, в строительстве при выемке грунта и дроблении скальных пород, при обрушении старых зданий и конструкций. Взрывные технологии нашли применение при обработке металлов сверхвысоким давлением, получении материалов с особыми свойствами и в других случаях. ТГВ базируется на фундаментальных сведениях из физико-химии, гидрогазодинамики, теории тепло – и массообмена, термодинамики, теплотехники. Значительный вклад в развитие ТГВ внесли российские ученые: Д.И. Менделеев, академики Г.Г. Гесс, Я.Б. Зельдович, Н.Н. Семенов, профессора Д.А. Франк–Каменецкий, Г.Ф. Кнорре, В.В. Померанцев, Л.Н. Хитрин, К.И. Щелкин, Е.С. Щетинков, А.В. Талантов и др. Из зарубежных специалистов в области горения и взрыва следует отметить К.М. Гульдберга, П. Вааге, Я.Х. Вант-Гоффа, В. Нернста, Д. Драйздейла, Г. Дамкёлера, Д. Сполдинга, Б. Льюиса, Г. Эльбе и многих других. При подготовке специалистов по защите в чрезвычайных ситуациях, безопасности жизнедеятельности, пожарной безопасности она дает необходимый инструментарий при оценке динамики развития пожаров, расследовании последствий техногенных взрывов, разработке противовзрывных устройств, средств пожаротушения и др.
Основные понятия и определения Горючая система – совокупность материальных тел, находящихся между собой в энергетическом (тепловом, термохимическом) взаимодействии. Она включает в себя горючие вещества, окислители, источники воспламенения (зажигания), катализаторы, флегматизаторы (замедлители химических реакций) и др. компоненты. Тела, находящиеся вне границ горючей системы, но могущие оказывать на нее воздействие, относятся к окружающей среде (о.с). Горючие вещества могут находиться в различных агрегатных состояниях: твердом, жидком, газообразном. К твердым горючим веществам относятся ископаемые угли, торф, горючие сланцы, древесина и древесные отходы, различные синтетические материалы. Жидкие горючие вещества – это нефть и продукты ее переработки (бензин, керосин, мазут, моторные топлива), газовый конденсат и др. Газообразные горючие вещества – это природные углеводородные и искусственные газы, попутный газ нефтяных месторождений. В качестве окислителей в горючих системах используются воздух, кислород, хлор, фтор, а также различные газовые смеси, содержащие воздух. Источники зажигания – открытое пламя, факелы, фитили, смоченные горючей жидкостью, спички, электроискровые разрядники, молния. Горючие системы могут быть открытыми и закрытыми, одно– и многокомпонентными, одно – и многофазными, гомогенными и гетерогенными, конденсированными (газожидкостными). Наибольшее значение имеют открытые системы. Открытыми называются системы, через границы которых может проходить (протекать) масса вещества. Примерами открытых горючих систем могут являться газо – и нефтепроводы, вентиляционные системы, открытые пожары, канальные пламяпреградители, взрывные клапаны и др. Закрытые системы – это, например, газовые баллоны со сжатым горючим газом, большие емкости для хранения газов (газгольдеры) и нефтепродуктов (цистерны), закрытые помещения при утечке бытового газа. Гомогенные горючие системы – однородные по своим физико – химическим свойствам во всем объёме системы, например, смеси горючего газа с кислородом или воздухом. Гетерогенные горючие системы – разнородные по своим физико – химическим свойствам во всем объеме системы, например, твердое горючее вещество + окислитель, жидкое горючее вещество + окислитель. Гомогенная часть гетерогенной системы называется фазой. Фазы отделяются друг от друга поверхностями раздела.
Состав и теплота сгорания горючих веществ В состав твердых и жидких горючих веществ входят горючие компоненты: углерод C, водород H, летучая сера (сумма содержания органической и колчеданной серы в виде пирита FeS2 и халькопирита CuFeS2) Sл = Sор + Sк. Сульфатная и сульфитная сера, входящая в состав солей: сульфатов и сульфитов, не участвует в горении и переходит в золу. Полный состав может быть задан на различные массы: рабочую Cр + Hр + Sлр + Oр + Nр + Wр + Aр = 100%, (1) где Oр, Nр, Wр, Aр – процентное содержание соответственно кислорода, азота, влаги (воды) и золы; горючую Cг + Hг + Sлг + Oг + Nг = 100%, (2) сухую Cс + Hс + Sлс + Oс + Nс + Aс = 100%, (3) аналитическую (исключающую внешнюю влагу Wвн) Cа + Hа + Sла + Oа + Nа + Aа + Wa = 100% (4) и другие. Пересчет с одной массы горючего вещества на другую проводится умножением содержания соответствующего компонента на один из сомножителей K, представленных в табл. 1.
Таблица 1. Пересчетные сомножители K
Например, для углерода пересчет горючей массы на рабочую проводится по формуле
Состав газообразных горючих веществ обычно задается в % на сухой объём. Компонентами горючей смеси могут являться водород H2, сероводород H2S, углеводороды CmHn (метан CH4, этан С2H6, пропан С3H8 и др.), оксид углерода СO, диоксид углерода CO2, азот N2 и прочие газы H2 + H2S + ∑CmHn + CO + CO2 + N2 +…= 100% . (6) Важнейшая характеристика горючих веществ – теплота сгорания (теплотворная способность) Q. Под теплотой сгорания понимают количество теплоты, выделившейся при полном сгорании единицы количества горючего вещества. Для твердых и жидких горючих веществ теплота сгорания задаётся на рабочую массу Qр, для газообразных – на сухой объём Qс. Различают высшую (Qвр) и низшую (Qнр) теплоты сгорания, связанные между собой уравнением, кДж/кг Qвр = Qнр + Qпар = Qнр + 25(Wp + 9Hр) , (7) где Qпар – теплота, затрачиваемая на испарение влаги горючего вещества и воды, образующейся при окислении водорода по стехиометрической реакции 2H2 + O2 =2H2O; Wр, Hр – в %. В качестве расчетной характеристики в теплотехнике и теории горения обычно используется низшая теплота сгорания Qнр. Теплоту сгорания горючих веществ можно определить (оценить) двумя способами: 1. Экспериментально путем сжигания в среде кислорода небольшого количества горючего в специальных калориметрических установках. 2. Расчетным путем по тепловым эффектам химических реакций окисления горючих компонентов (формулы Д.И. Менделеева). Для твердых и жидких горючих веществ Qнр = 338Cр +1250Hр +109(Sлр – Op) – 25(Wp + 9Hр); (8) Для газообразных горючих веществ, кДж/м3
Тепловой (энергетический) эквивалент горючего вещества
где

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|












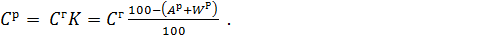 (5)
(5) (9)
(9) (10)
(10)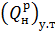 – теплота сгорания «условного» топлива, принимаемая равной
– теплота сгорания «условного» топлива, принимаемая равной 